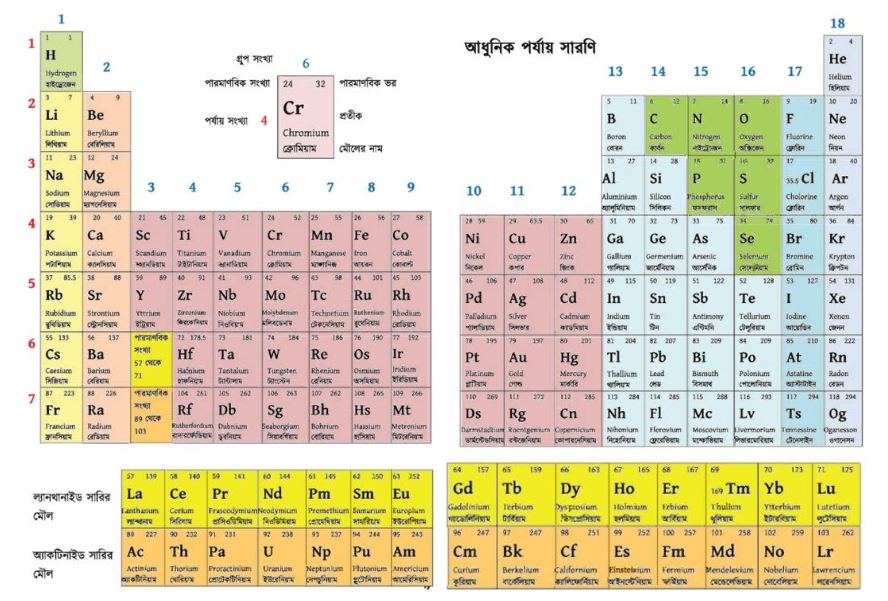
মৌলসমূহের ভৌত ও রাসায়নিক ধর্মের উপর ভিত্তি করে বিভিন্ন গ্রুপে উপস্থিত মৌলগুলাের বিশেষ নাম দেওয়া হয় । যেমন, পর্যায় সারণির 1 নং গ্রুপে 7 টি মৌল আছে। এদের মধ্যে হাইড্রোজেন ছাড়া বাকি 6টি মৌলকে (লিথিয়াম, সােডিয়াম, পটাশিয়াম, রুবিডিয়াম, সিজিয়াম এবং ফ্রানসিয়াম) ক্ষারধাতু বলে। অর্থাৎ H ছাড়া 1 নং গ্রুপের বিশেষ নাম হলো ক্ষারধাতু ।
নিচে পর্যায় সারণির 1 নং গ্রুপ তথা ক্ষারধাতুসমূহের বৈশিষ্ট উল্লেখ করা হলো:
** আমরা জানি, যে সকল মৌল পানির সাথে বিক্রিয়া করে ক্ষার ও হাইড্রোজেন গ্যাস তৈরি করে তাদেরকে ক্ষার ধাতু বলে। অর্থাৎ ক্ষারধাতুসমূহ পানির সাথে বিক্রিয়া করে ক্ষার ও হাইড্রোজেন গ্যাস উৎপন্ন করে। যেমন, সোডিয়াম (Na) পানির সাথে বিক্রয়া করে বা পানিতে দ্রবীভূত হয়ে সোডিয়াম হাইড্রোক্সাইড ও হাইড্রোজেন গ্যাস তৈরি করে।
2Na(s) + 2H2O (I) = 2NaOH (aq) + H2(g)
** 1 নং গ্রুপের মৌলসমূহের ইলেট্রন বিন্যাস করলে প্রত্যেকের সবচেয়ে বাহিরের সেলে 1 টি করে ইলেক্ট্রন থাকে ।
যেমন,
Li(3)= 1s22s1
Na(11)= 1s2 2s22p6 3s1
** ক্ষারধাতুসমূহ প্রত্যেকে 1টি করে ইলেকট্রন ত্যাগ করে একক ধনাত্মক চার্জ যুক্ত আয়ন বা ক্যাটায়ন উৎপন্ন করে।
যেমন,
Li -e– → Li+
Na -e– → Na+
এজন্য ক্ষারধাতুসমূহের জারণ সংখ্যা +1
*** ক্ষারধাতুসমূহ নরম এবং এদের গলনাঙ্ক ও স্ফুটনাঙ্ক তুলনামূলকভাবে কম।
*** 1 নং গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে ধাতুসমূহের পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত বাড়তে থাকে। ফলে আয়নিকরণ শক্তি, ইলেকট্রন আসক্তি , তড়িৎ ঋণাত্মকতার মান কম হয়।
*** পারমাণবিক সংখ্যা বৃদ্ধির অর্থাৎ 1 নং গ্রুপের উপর দিক থেকে নিচের দিকে যাওয়ার সাথে সাথে ক্ষারধাতুসমূহের সক্রিয়তা বৃদ্ধি পায়।
**** ক্ষারধাতুসমূহ অর্থাৎ 1 নং গ্রুপের মৌলসমূহ আয়নিক যৌগ গঠন করে। এদের যৌগসমূহ পানিতে দ্রবনীয় এবং গলিত/দ্রবীভূত অবস্থায় বিদ্যুৎ পরিবাহী।
*** 1 নং গ্রুপের মৌলসমূহ খুব সক্রিয় বলে মুক্ত অবস্থায় প্রকৃতির মধ্যে পাওয়া যায় না।
লঘু এসিডের সাথে বিক্রিয়া:
এই গ্রুপের মৌলগুলো লঘু এসিডের সাথে তীব্রভাবে বিক্রিয়া করে ধাতব লবণ ও হাইড্রোজেন গ্যাস উৎপন্ন করে।
2Na + 2HCl(aq) = 2NaCl + H2
হ্যালোজেনের সাথে বিক্রিয়া:
1 নং গ্রুপের মৌলগুলো হ্যালোজেনের সাথে বিক্রিয়া করে ধাতব হ্যালাইড গঠন করে যা আয়নিক বৈশিষ্টের।
যেমন: 2Na + Cl2 = 2NaCl