মিথেন(CH4) অণু গঠনে অষ্টক ও দুই এর নিয়ম ব্যাখ্যা: আমরা জানি, মিথেন এর মধ্যে সমযোজী বন্ধন বিদ্যমান অর্থাৎ CH4 একটি সমযোজী যৌগ। নিচে CH4 এর গঠন চিত্র দেখানো হলো:
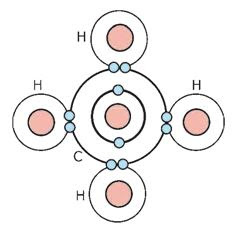
উপরের গঠন চিত্র থেকে দেখা যায় যে, একটি কার্বন পরমাণু, চারটি হাইড্রোজেন পরমাণুর সাথে ইলেক্ট্রন শেয়ার বা ভাগাভাগির মাধ্যমে CH4 অণু গঠন করে। এক্ষেত্রে মিথেন অণুর কেন্দ্রীয় কার্বন পরমাণুর সর্বশেষ শক্তিস্তরে অবস্থিত 4 টি ইলেক্ট্রন, 4 টি হাইড্রোজেন পরমাণুর 4 টি ইলেক্ট্রনের সাথে একক সমযোজী বন্ধনের মাধমে যুক্ত থাকে।
ফলে CH4 এ কার্বন পরমাণুর সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন বিদ্যমান থাকে । যেখানে 4 টি ইলেকট্রন কার্বনের নিজস্ব আর বাকি 4 টি ইলেকট্রন চারটি হাইড্রোজেন পরমাণু থেকে আসে। অর্থাৎ কার্বন পরমাণুর সর্বশেষ শক্তিস্তরে 8 টি ইলেকট্রন অর্জিত হয় অর্থাৎ এটি অষ্টক নিয়ম মেনে চলে।আবার, যেহেতু কার্বন পরমাণুর সর্বশেষ শক্তিস্তরে 8 টি বা 4 জোড়া ইলেকট্রন থাকে, সেহেতু ইহা দুই এর নিয়মও মেনে চলে।
অপরদিকে প্রতি হাইড্রোজেন পরমাণুর সর্বশেষ শক্তিস্তরে 2টি করে ইলেকট্রন বিদ্যমান থাকে। তাই এটি অষ্টক নিয়ম মেনে চলে না। তবে যেহেতু প্রতি হাইড্রোজেন পরমাণুর সর্বশেষ শক্তিস্তরে 2টি তথা 1 জোড়া ইলেকট্রন থাকে, সেহেতু প্রতি হাইড্রোজেন পরমাণুরই দুই এর নিয়মও মেনে চলে।
পরিশেষে আমরা বলতে পারি, মিথেন(CH4) অণু গঠনে কার্বন পরমাণু অষ্টক ও দুই এর উভয় নিয়ম মেনে চলেও হাইড্রোজেন পরমাণু শুধু দুই এর নিয়মও মেনে চলে।