নিচের Start বাটনে ক্লিক করে বহুনির্বাচনি পরীক্ষা শুরু করুন। পরীক্ষা শেষে রেজাল্ট দেখুন। স্কোর ১০০% না হওয়া পর্যন্ত বার বার পরীক্ষা দিন। নিজের স্কিল বাড়ান ।
[ays_quiz_cat id=”6″ display=”all/random” count=”5″ layout=”list/grid”]
পদার্থের অণুতে পরমাণুসমূহ কীভাবে থাকে ?
পদার্থের অণুতে পরমাণুসমূহ সুবিন্যস্তভাবে থাকে।
বন্ধন বা রাসায়নিক বন্ধন কাকে বলে?
যে আকর্ষণ শক্তির মাধ্যমে অণুতে দুটি পরমাণু পর যুক্ত থাকে তাকে রসায়নিক বন্ধন বলে।
বন্ধন বা রাসায়নিক বন্ধন কতপ্রকার ও কী কী?
রাসায়নিক বন্ধন বিভিন্ন প্রকার হয়। তবে প্রধান রাসায়নিক বন্ধন দুই প্রকার। যেমন :
(১) আয়নিক বা তড়িৎযােজী বন্ধন।
(২) সমযােজী বন্ধন
এছাড়া আরো রাসায়নিক বন্ধন আছে ।
(১) সন্নিবেশ বন্ধন
(২) ধাতব বন্ধন।
(৩) হাইড্রোজেন বন্ধন।
(৪) ভ্যান্ডার ওয়ালস বল ইত্যাদি।
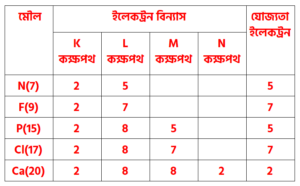
যোজনী ইলেকট্রন বা যােজ্যতা ইলেকট্রন বা যােজ্যতা ইলেকট্রন সংখ্যা কাকে বলে ?
কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যে ইলেকট্রন বা ইলেকট্রনসমূহ থাকে তার সংখ্যাকে যোজনী ইলেকট্রন বা যােজ্যতা ইলেকট্রন বা যােজ্যতা ইলেকট্রন সংখ্যা বলা হয়। যেমন : পটাশিয়ামের পারমাণবিক সংখ্যা 19 এবং ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 3p64s1 অর্থাৎ পটাশিয়ামের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে 1টি ইলেকট্রন বিদ্যমান। সুতরাং পটাশিয়ামের যােজ্যতা ইলেকট্রন সংখ্যা 1টি ।আবার, অক্সিজেনের পারমাণবিক সংখ্যা 8 এবং ইলেকট্রন বিন্যাস 1s2 2s2 2p4 অর্থাৎ অক্সিজেনের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে 6টি ইলেকট্রন বিদ্যমান। সুতরাং অক্সিজেনের যােজ্যতা ইলেকট্রন সংখ্যা 6টি ।
অথবা
যেমন: পটাশিয়াম ও অক্সিজেনের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যথাক্রমে 1টি ও 6টি করে ইলেকট্রন বিদ্যমান।
সুতরাং K এর যােজ্যতা ইলেকট্রন 1 টি এবং অক্সিজেনের যােজ্যতা ইলেকট্রন 6 টি।
বিভিন্ন মৌলের যােজ্যতা ইলেকট্রন
বিভিন্ন মৌলের পরমাণুসমূহ কীভাবে অণু গঠন করে?
বিভিন্ন মৌলের পরমাণুসমূহ একে অপরের সাথে সর্বশেষ কক্ষপথের ইলেকট্রন বর্জন, গ্রহণ অথবা ভাগাভাগির মাধ্যমে অণু গঠন করে।
যােজনী স্তর বা যােজ্যতা স্তর বা যােজনী শেল কী ?
কোনাে পরমাণুর ইলেক্ট্রন বিন্যাসে সর্বশেষ কক্ষপথকে যােজনী স্তর বা যােজ্যতা স্তর যােজনী শেল বলে।
যােজনী বা যােজ্যতা কাকে বলে ? যােজ্যতা ইলেকট্রন সংখ্যা হতে কীভাবে মৌলের যােজনী নির্ণয় করা যায়?
অণু গঠনকালে কোনাে মৌলের একটি পরমাণুর সাথে অপর একটি মৌলের পরমাণু যুক্ত হওয়ার সামর্থ্য বা ক্ষমতাকে যােজনী বা যােজ্যতা বলে ।
যােজনীর আধুনিক সংজ্ঞা : কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বেজোড় ইলেকট্রন থাকে তাকে ঐ মৌলের যােজনী বা যােজ্যতা বলে।
ধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের ইলেকট্রন সংখ্যা এবং অধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের বেজোড় ইলেকট্রন সংখ্যা মৌলের যােজ্যতা নির্দেশ করে। যেমন- সোডিয়াম একটি ধাতু । সোডিয়ামের পারমাণবিক সংখ্যা 11 এবং ইলেকট্রন বিন্যাস Na= 1s2 2s2 2p6 3s1
যেহেতু, সোডিয়ামের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে 1টি ইলেকট্রন বিদ্যমান। সুতরাং সোডিয়ামের যোজনী 1
অপরদিকে, অক্সিজেন একটি অধাতু। অক্সিজেনের পারমাণবিক সংখ্যা 8 এবং ইলেকট্রন বিন্যাস
O= 1s2 2s2 2px2 2py1 2pz1
যেহেতু, অক্সিজেনের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে বেজোড় ইলেকট্রন সংখ্যা 2। সুতরাং অক্সিজেনের যোজনী 2
কীভাবে যােজনী পরিমাপ করা হয় ? অথবা যােজনীর গাণিতিক সংজ্ঞা:
কোনাে মৌলের একটি পরমাণু যতগুলাে ঐ পরমাণু বা H পরমাণু বা তার সমতুল্য (Cl, F, Br, I) পরমাণুর সাথে যুক্ত হতে পারে সেই সংখ্যাই হলাে ঐ মৌলের যােজনী বা যােজ্যতা।
যেমন-হাইড্রোজেনের একটি পরমাণু ক্লোরিনের একটি পরমাণুর সাথে যুক্ত হয়ে HCl অণু গঠিত হয়, তাই ক্লোরিনের যােজনীও 1 (এক)।
আবার অক্সিজেনের একটি পরমাণু হাইড্রোজেনের দুটি পরমাণুর সাথে যুক্ত হয়ে H2O তৈরি করে, এজন্য অক্সিজেনের যােজনী 2 (দুই)।
একটি Na পরমাণু একটি Cl পরমাণুর সাথে যুক্ত হয়ে NaCl গঠিত হয়। সুতরাং Na এর যােজনী 1 (এক)।
আবার, একটি পরমাণুর সাথে যতটি অক্সিজেন পরমাণু যুক্ত হয় তার সেই সংখ্যার দ্বিগুণ করলে ঐ পরমাণুর যােজনী বা যােজ্যতা হয়। অথবা কোনাে মৌলের একটি পরমাণু যতটি অক্সিজেন পরমাণুর সাথে যুক্ত সেই সংখ্যাকে সেই সংখ্যার দ্বিগুণ করলে ঐ পরমাণুর যােজনী বা যােজ্যতা পাওয়া যায়।
যেমন : ক্যালসিয়াম (Ca) এর একটি পরমাণু একটি অক্সিজেন (O) পরমাণুর সাথে যুক্ত হয়ে ক্যালসিয়াম অক্সাইড (CaO) তৈরি করে। এখানে অক্সিজেন পরমাণুর সংখ্যা 1 এই সংখ্যাকে 2 দ্বারা গুণ করলে হয় 2। কাজেই ক্যালসিয়ামের যােজনী 2।
যোজনী কত প্রকার ও কী কী ?
যোজনী সাধারণত 4 প্রকার । যথা:
১)সক্রিয় যোজনী বা কার্যকরী যোজনী
২) পরিবর্তনশীল যােজনী
৩ )সর্বোচ্চ যােজনী
৪) সুপ্ত যােজনী
সক্রিয় যোজনী বা কার্যকরী কাকে বলে ?
কোনো যৌগে কোনো মৌলের যে যোজনী বর্তমানে কার্যকর বা ক্রিয়ারত থাকে তাকে ঐ মৌলের সক্রিয় যোজনী বা কার্যকরী যোজনী বলে। যেমন -ক্যালসিয়াম অক্সাইডে (CaO) ক্যালসিয়ামের যোজনী ২ ব্যবহৃত হয়েছে । সুতরাং ক্যালসিয়ামের সক্রিয় যোজনী ২
পরিবর্তনশীল যােজনী কাকে বলে ?
কোনাে মৌলের একাধিক যােজনী থাকলে সেই মৌলের যােজনীকে পরিবর্তনশীল যােজনী বলা হয়। যেমন: Fe এর পরিবর্তনশীল যােজনী 2 এবং 3।
সর্বোচ্চ যােজনী কাকে বলে ?
অণু গঠনে সময় কোনো মৌলের পরমাণু পরিবর্তনশীল যােজনীর মধ্যে সর্বোচ্চ যে যোজনী ব্যবহার করতে পারে তাকে সর্বোচ্চ যােজনী বলে ।
সুপ্ত যােজনী কাকে বলে ?
কোনাে মৌলের সর্বোচ্চ যােজনী এবং সক্রিয় যােজনীর পার্থক্যকে ঐ মৌলের সুপ্ত যােজনী বলা হয়। যেমন: FeCl2 যৌগে Fe এর সক্রিয় যােজনী 2 কিন্তু Fe এর সর্বোচ্চ যােজনী 3 অতএব FeCl2 যৌগে Fe এর সুপ্ত যােজনী 3 – 2=1 । আবার FeCl3 যৌগে Fe এর সক্রিয় যােজনী 3 কিন্তু Fe এর সর্বোচ্চ যােজনী 3, অতএব FeCl3 যৌগে Fe এর সুপ্ত যােজনী 3 – 3 = 0 ।
কোনো মৌল পরিবর্তনশীল যােজ্যতা বা একাধিক যােজ্যতা প্রদর্শন করে কেন ?
কোনাে মৌলের সর্বশেষ কক্ষপথের উপস্তরসমূহের মধ্যে ইলেকট্রন পুনর্বিন্যাসের কারণে বেজোড় ইলেকট্রন সংখ্যা পরিবর্তিত হয়। ফলে মৌলটি পরিবর্তনশীল যােজ্যতা বা একাধিক যােজ্যতা প্রদর্শন করে। অধাতব মৌল ও উচ্চ পারমাণবিক সংখ্যা বিশিষ্ট ধাতব মৌল পরিবর্তনশীল যােজ্যতা প্রদর্শন করে |
সালফার পরিবর্তনশীল যােজ্যতা প্রদর্শন করে কেন? সালফারের যােজনী 2, 4, 6 কেন ?
আমরা জানি, কোনাে মৌলের একাধিক যােজনী থাকলে সেই মৌলের যােজনীকে পরিবর্তনশীল যােজনী বলা হয়। কোনাে মৌলের সর্বশেষ কক্ষপথের উপস্তরসমূহের মধ্যে ইলেকট্রন পুনর্বিন্যাসের কারণে বেজোড় ইলেকট্রন সংখ্যা পরিবর্তিত হয়। ফলে মৌলটি পরিবর্তনশীল যােজ্যতা বা একাধিক যােজ্যতা প্রদর্শন করে। সালফারের পারমাণবিক সংখ্যা 16 এবং স্বাভাবিক অবস্থায় ইলেকট্রন বিন্যাস 16S = 1s2 2s2 2p6 3s2 3px2 3py1 3pz1
অর্থাৎ স্বাভাবিক অবস্থায় সালফারের সর্বশেষ কক্ষপথে বেজোড় ইলেকট্রন সংখ্যা 2 সুতরাং সালফারের যােজনী 2
কিন্তু উত্তেজিত অবস্থায় এর ইলেকট্রন বিন্যাস
16S* = 1s2 2s2 2p6 3s2 3px1 3py1 3pz1 3dxy1
16S** = 1s2 2s2 2p6 3s1 3px1 3py1 3pz1 3dxy13dyz1
উত্তেজিত অবস্থায় ইলেকট্রন বিন্যাস হতে দেখা যায় যে, এর সর্বশেষ কক্ষপথের উপস্তরসমূহের মধ্যে ইলেকট্রন পুনর্বিন্যাস ঘটে । ফলে বেজোড় ইলেকট্রন সংখ্যা পরিবর্তিত হয়ে যথাক্রমে 4 ও 6 হয়। অর্থাৎ
উত্তেজিত অবস্থায় সালফারের যােজনী যথাক্রমে 4 ও 6 ।
সুতরাং , সালফারের যােজনী 2, 4, 6 অর্থাৎ সালফার পরিবর্তনশীল যােজ্যতা প্রদর্শন করে ।
কতিপয় মৌলের ইলেক্ট্রন বিন্যাস ও যোজ্যতা ইলেক্ট্রন :
উচ্চ পারমাণবিক সংখ্যা বিশিষ্ট ধাতব মৌল পরিবর্তনশীল যােজ্যতা প্রদর্শন করে কেন ? আয়রনের এর যােজনী 2 ও 3 হয় কেন ? আয়রন ফেরাস ও ফেরিক আয়ন এ পরিণত হয় কেন ?
আমরা জানি, কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বেজোড় ইলেকট্রন থাকে তাকে ঐ মৌলের যােজনী বলে। আয়রনের পারমাণবিক সংখ্যা 26 এবং ইলেকট্রন বিন্যাস 26Fe = 1s2 2s2 2p6 3s2 3p6 3d6 4s2
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, আয়রনের সর্বশেষ শক্তিস্তরের 4s অর্বিটালে 2 টি ইলেকট্রন আছে । পরমাণুটি এই দুটি ইলেকট্রন সহজেই ত্যাগ করে Fe2+ আয়ন এ পরিণত হয় । Fe -2e– → Fe2+
তাই আয়রনের যােজনী 2
যেমন, FeO যৌগে আয়রনের যােজনী 2
Fe2+ আয়নের ইলেকট্রন বিন্যাস
26 Fe2+ = 1s2 2s2 2p6 3s2 3p6 3d6
বিন্যাস হতে দেখা যায় যে, Fe2+ এর 3d অর্বিটালে 6টি ইলেকট্রন আছে । আমরা জানি,অর্ধপূর্ণ ও পরিপূর্ণ ইলেকট্রন বিন্যাস সর্বাধিক সুস্থিত। অর্থাৎ 3d6 গঠন অপেক্ষা 3d5 গঠন অধিক সুস্থিত। তাই উপযুক্ত জারকের উপস্থিতিতে Fe2+ আয়ন থেকে আরও একটি ইলেকট্রন সহজেই ত্যাগ করে Fe3+ আয়ন এ পরিণত হয় ।
Fe2+ -e– → Fe3+
তখন Fe3+ আয়নের ইলেকট্রন বিন্যাস
Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5
তাই আয়রনের যােজনী 3 ও হয়।
যেমন, Fe2O3 যৌগে আয়রনের যােজনী 3
সুতরাং উপরিউক্ত আলােচনার থেকে বলা যায় যে, আয়রন মৌলটির যােজনী 2 ও 3 উভয়ই
হতে পারে অর্থাৎ Fe পরিবর্তনশীল যােজ্যতা প্রদর্শন করে ।
কোনো মৌলের যােজ্যতা ইলেকট্রন সংখ্যা হতে কীভাবে মৌলের যােজনী নির্ণয় করা যায়? যোজনী ইলেক্ট্রন থেকে কোনো মৌলের যোজনী নির্ণয়ের কৌশল ব্যাখ্যা করো।
সাধারণত কোনাে মৌলের যােজনী এর যােজ্যতা ইলেকট্রনের সমান অথবা আট(8) হতে যােজ্যতা ইলেকট্রন সংখ্যা বাদ দিলে যে সংখ্যা পাওয়া যায় তার সমান। কারণ একই মৌলের বা ভিন্ন মৌলের দুটি পরমাণু যখন কাছাকাছি অবস্থান করে তখন তারা তাদের সর্বশেষ শক্তিস্তরে ইলেকট্রন গ্রহণ, বর্জন বা ভাগাভাগির মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জন করে। ধাতুসমূহের সর্বশেষ শক্তিস্তরে সাধারণত 1, 2 বা 3টি ইলেকট্রন থাকে। এই 1, 2 বা 3টি ইলেকট্রনই তাদের যোজনী এবং যােজ্যতা ইলেকট্রন উভয়ই ।
অপরদিকে অধাতুসমূহের সর্বশেষ শক্তিস্তরে সাধারণত 5, 6 বা 7 টি ইলেকট্রন থাকে । এই 5, 6 বা 7 টি ইলেকট্রন তাদের যােজ্যতা ইলেকট্রন কিন্তু যোজনী নয় । 8 হতে এই 5, 6 বা 7 ইলেক্ট্রন সংখ্যা বিয়োগ করলে যে সংখ্যা পাওয়া যায় তাই তাদের যোজনী। আবার যে সকল মৌলের সর্বশেষ শক্তিস্তরে 4 টি ইলেক্ট্রন থাকে তাদের যোজনী এবং যােজ্যতা ইলেকট্রন উভয়ই 4 । কারণ 8-4=4 |
অতএব,
(১) যদি কোনাে মৌলের যােজ্যতা ইলেকট্রন সংখ্যা <4 হয় তবে, ঐ মৌলের যােজনী = যােজ্যতা ইলেকট্রন সংখ্যা।
(২) যদি কোনো মৌলের যােজ্যতা ইলেকট্রন সংখ্যা ≥ 4 হয় তবে, ঐ মৌলের যােজনী = 8 – যােজনী ইলেক্ট্রন সংখ্যা।
যেমন -ম্যাগনেসিয়ামের পারমাণবিক সংখ্যা 12 । এর ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 । অর্থাৎ এর শেষ কক্ষপথে 2 টি ইলেকট্রন রয়েছে । সুতরাং, ম্যাগনেসিয়ামের যােজ্যতা ইলেকট্রন সংখ্যা 2 এবং ম্যাগনেসিয়ামের যােজনীও 2 । আবার, ক্লোরিনের পারমাণবিক সংখ্যা 17। এর ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 3p5 অর্থাৎ এর শেষ কক্ষপথে 7 টি ইলেকট্রন রয়েছে। সুতরাং, ক্লোরিনের যােজ্যতা ইলেকট্রন সংখ্যা 7 এবং ক্লোরিনের যােজনী = 8 – 7 = 1
নীচের মৌলগুলোর যােজ্যতা ও যােজ্যতা ইলেকট্রন সংখ্যা এক নয় কেন ?
F, Cl, Br, I, O, C, S, P, N
কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বেজোড় ইলেকট্রন থাকে তাকে মৌলের যােজ্যতা বা যোজনী বলে। আবার কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যে ইলেকট্রন বা ইলেকট্রনসমূহ থাকে তার সংখ্যাকে যােজ্যতা ইলেকট্রন সংখ্যা বলা হয়।
ফ্লোরিনের ইলেকট্রন বিন্যাস নিম্নরূপ-
9F = 1s 2 2s 2 2px2 2py2 2pz1
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, ফ্লোরিনের সর্বশেষ প্রধান শক্তিস্তরে 7 টি ইলেকট্রন বিদ্যমান এবং বেজোড় ইলেকট্রন সংখ্যা 1 টি। তাই ফ্লোরিনের যােজ্যতা ইলেকট্রন সংখ্যা 7 টি এবং যােজ্যতা 1 । সুতরাং ফ্লোরিনের যােজ্যতা ও যােজ্যতা ইলেকট্রন সংখ্যা এক নয় ।
যৌগমূলক কাকে বলে?
ভিন্ন ভিন্ন মৌলের পরমাণু বা আয়ন এর সমন্বয়ে গঠিত ধনাত্মক বা ঋণাত্মক আধানবিশিষ্ট একটি পরমাণুগুচ্ছ যা একটি আয়নের ন্যায় আচরণ করে তাকে যৌগমূলক বলে। যেমন NH4+, SO4-2, OH– ইত্যাদি ।
NH4+ কে যৌগমূলক বলা হয় কেন ?
আমরা জানি, ভিন্ন ভিন্ন মৌলের পরমাণু বা আয়ন এর সমন্বয়ে গঠিত ধনাত্মক বা ঋণাত্মক আধানবিশিষ্ট একটি পরমাণুগুচ্ছ যা একটি আয়নের ন্যায় আচরণ করে তাকে যৌগমূলক বলে। NH4+ একটি যৌগমূলক। এর নাম অ্যামােনিয়াম। একটি N পরমাণুর সাথে তিনটি H পরমাণু ও একটি H+ যুক্ত হয়ে অ্যামােনিয়াম (NH4+) আয়ন নামক যৌগমূলকের সৃষ্টি করে।এটি বিভিন্ন বিক্রিয়ায় একক ধনাত্বক আয়ন হিসেবে আচরণ করে। যেমন :
NH4OH + HCl= NH4Cl+ H2O
সুতরাং NH4+ একটি যৌগমূলক।
যৌগমূলক কত প্রকার ও কী কী ?
যৌগমূলক দুই প্রকার। যথা : ধনাত্মক যৌগমূলক ও ঋণাত্মক যৌগমূলক।
ধনাত্মক যৌগমূলক: ভিন্ন ভিন্ন মৌলের পরমাণু বা আয়ন এর সমন্বয়ে গঠিত ধনাত্মক আধানবিশিষ্ট একটি পরমাণুগুচ্ছ যা একটি আয়নের ন্যায় আচরণ করে তাকে ধনাত্মক যৌগমূলক বলে। যেমন: NH4+ , PH4+
ঋণাত্মক যৌগমূলক:ভিন্ন ভিন্ন মৌলের পরমাণু বা আয়ন এর সমন্বয়ে গঠিত ঋণাত্মক আধানবিশিষ্ট একটি পরমাণুগুচ্ছ যা একটি আয়নের ন্যায় আচরণ করে তাকে ঋণাত্মক যৌগমূলক বলে। যেমন: SO42-, OH– ইত্যাদি ।
যৌগমূলকের যোজনী কীভাবে নির্ণয় করবে ?
যৌগমূলকের আধান সংখ্যাই মূলত এদের যােজনী নির্দেশ করে। যেমন: একটি N পরমাণুর সাথে তিনটি H পরমাণু ও একটি H+ যুক্ত হয়ে অ্যামােনিয়াম (NH4+) আয়ন নামক যৌগমূলকের সৃষ্টি করে। এর আধান সংখ্যা হলাে +1 (এক)। সূতরাং এর যােজনী 1 (এক)।
আধান বা চার্জ ও যােজনী এর মধ্যে পার্থক্য কী ?
আধান বা চার্জ ধনাত্মক বা ঋণাত্মক হতে পারে কিন্তু যােজনী শুধু একটি সংখ্যা এর কোনাে ধনাত্মক চিহ্ন বা ঋণাত্মক চিহ্ন নেই। (NH4+) আয়ন নামক যৌগমূলকের আধান সংখ্যা হলাে +1 (এক)। সূতরাং এর যােজনী 1 (এক)।
সংকেত বা আণবিক সংকেত বা রাসায়নিক সংকেত কাকে বলে?
একটি মৌল বা যৌগের অণুতে যে যে ধরনের মৌলের পরমাণু থাকে তাদের প্রতীক এবং যে মৌলের পরমাণু যতটি থাকে সেই সকল সংখ্যা দিয়ে প্রকাশিত সংকেতকে আণবিক সংকেত বা রাসায়নিক সংকেত বলে।
যেমন: দুটি হাইড্রোজেন (H) পরমাণু ও একটি অক্সিজেন (O) পরমাণু মিলে পানির (H2O) একটি অণু গঠিত হয়। এখানে, H2O হলাে পানির অণুর রাসায়নিক সংকেত।
গাঠনিক সংকেত কাকে বলে?
একটি অণুতে মৌলের পরমাণুগুলাে যেভাবে সাজানাে থাকে প্রতীক এবং বন্ধনের মাধ্যমে তা প্রকাশ করাকে গাঠনিক সংকেত বলে।
যেমন: তিনটি কার্বন (C) পরমাণু আটটি হাইড্রোজেন (H) পরমাণুর সাথে যুক্ত হয়ে প্রােপেন (C3H8) অণু গঠিত হয়। প্রােপেনের C3H8 এই সংকেতটিকে আণবিক সংকেত বা রাসায়নিক সংকেত বলে। আবার উক্ত যৌগে কার্বন পরমাণু তিনটি একে অপরের সাথে শিকল আকারে যুক্ত হয় এবং অবশিষ্ট যোজনীগুলাে হাইড্রোজেন দ্বারা পূর্ণ হয়ে প্রতিটি কাবর্নের যােজনী 4 হয়। নিচের চিত্রে প্রােপেনের গাঠনিক সংকেত দেখানাে হলাে:
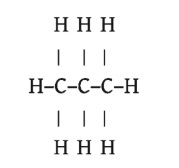
আবার পানির আণবিক সংকেত H2O, অতএব এর গাঠনিক সংকেত হবে
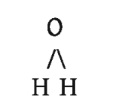
মিথেনের আণবিক সংকেত CH4 অতএব মিথেনের গাঠনিক সংকেত হবে
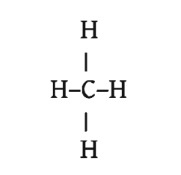
দ্বিত্ব কী?
অণু গঠনকালে কোনাে মৌল ইলেকট্রন গ্রহণ, বর্জন অথবা ভাগাভাগির মাধ্যমে তার সর্বশেষ শক্তিস্তরে ২ টি করে ইলেকট্রন ধারণের মাধ্যমে হিলিয়াম গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। একেই ‘দ্বিত্ব’ বলা হয়।
‘অষ্টক’ নিয়ম কাকে বলে ?
অণু গঠনকালে কোনাে মৌল ইলেকট্রন গ্রহণ, বর্জন অথবা ভাগাভাগির মাধ্যমে তার সর্বশেষ শক্তিস্তরে ৪টি করে ইলেকট্রন ধারণের মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। একেই ‘অষ্টক’ নিয়ম বলা হয়।
যেমন: CH4 অণুতে কেন্দ্রীয় পরমাণু কার্বনের সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন বিদ্যমান। যেখানে 4 টি ইলেকট্রন কার্বনের নিজস্ব আর বাকি 4 টি ইলেকট্রন চারটি হাইড্রোজেন পরমাণু থেকে আসে।
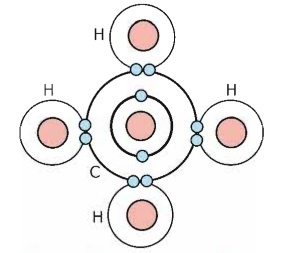
এভাবে পরমাণুসমূহ তার সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন ধারণ করে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভের মাধ্যমে যৌগ গঠনের পদ্ধতিকে ‘অষ্টক’ নিয়ম বলে।
সমযােজী যৌগে অষ্টক নিয়মের ব্যতিক্রম আলােচনা কর।
অণু গঠনকালে কোনাে মৌল ইলেকট্রন গ্রহণ, বর্জন অথবা ভাগাভাগির মাধ্যমে তার সর্বশেষ শক্তিস্তরে ৪টি করে ইলেকট্রন ধারণের মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। একেই ‘অষ্টক’ নিয়ম বলা হয়। হিলিয়াম ব্যতীত সকল নিষ্ক্রিয় গ্যাস পরমাণুর সর্বশেষ কক্ষপথ অষ্টক পূর্ণ। এছাড়া সকল আয়নেও অষ্টক পূর্ণ থাকে। তবে কিছু কিছু সমযােজী যৌগে এর ব্যতিক্রম দেখা যায়। যেমন-
অষ্টক সম্প্রসারণ : কিছু কিছু সমযােজী যৌগ গঠনে কেন্দ্রীয় পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে আট (8 টির ) এর চেয়ে বেশি সংখ্যক ইলেকট্রন অর্জিত হয়। একে অষ্টক সম্প্রসারণ বলে। সাধারণত পর্যায় সারণির 15, 16 ও 17 নং গ্রুপের বেশিরভাগ মৌল অষ্টক সম্প্রসারণের মাধ্যমে যৌগ গঠন করে । যেমন : PCl5 অণুতে ফসফরাস পরমাণুর অষ্টক সম্প্রসারণ ঘটে। ফসফরাস পেন্টা ক্লোরাইড( PCl5) অণুর ক্ষেত্রে ফসফরাস পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে 10 টি ইলেকট্রন অর্জিত হয় অর্থাৎ অষ্টক সম্প্রসারণ ঘটে। ফসফরাস ও ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ-
15 P = 1s2 2s2 2p6 3s2 3px1 3py1 3pz1
17Cl = 1s2 2s2 2p6 3s2 3px2 3py2 3pz1
উপরের ইলেকট্রন বিন্যাস থেকে দেখা যায় যে, সাধারণ অবস্থায় ফসফরাস পরমাণর বহিঃস্তরে 3টি বিজোড় ইলেকট্রন এবং ক্লোরিন পরমাণুর বিহিঃস্তরে 1 টি বিজোড় ইলেকট্রন আছে । কিন্তু উত্তেজিত অবস্থায় ফসফরাস পরমাণুর 3s উপস্তরের 2 টি ইলেকট্রন ভেঙে একটি ইলেকট্রন ফাঁকা 3d অবিটালে উন্নীত হয় এবং অষ্টক সম্প্রসারণের মাধ্যমে সবচেয়ে বাহিরের শক্তিস্তরে 5টি বিজোড় সংখ্যক ইলেকট্রন অর্জিত হয়।
15P* = 1s2 2s2 2p6 3s1 3px1 3py1 3pz1 3pz1 3d1
ফলে ফসফরাসের 5টি বিজোড় ইলেকট্রন 5টি ক্লোরিন পরমাণুর বিজোড় ইলেকট্রনের সাথে যুক্ত হয়ে PCl5 অণু গঠন করে। এতে ফসফরাস পরমাণুর বহিঃস্তরে 10টি ইলেকট্রন অর্জিত হয়। অর্থাৎ ফসফরাস পেন্টা ক্লোরাইড PCl5 অণুতে ফসফরাস পরমাণুর অষ্টক সম্প্রসারণ ঘটে।

চিত্র : PCl5 অণুর বন্ধন গঠন
আরো কিছু যৌগে অষ্টক সম্প্রসারণ দেখা যায়।যেমন :

নিচের যৌগে অষ্টক সম্প্রসারণ ব্যাখ্যা করো ।
SF6 , SF4 , SO3 , SO2
অষ্টক সংকোচন : কিছু কিছু সমযােজী যৌগ গঠনে কেন্দ্রীয় পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে আট অপেক্ষা কম ইলেকট্রন অর্জিত হয়। একে অষ্টক সংকোচন বলে। সাধারণত পর্যায় সারণির 2 নং গ্রুপের Be এবং 13 নং গ্রুপের B ও AI অষ্টক সংকোচনের মাধ্যমে যৌগ গঠন করে।
যেমন : বোরন ট্রাই ফ্লোরাইড (BF3 ) অণুর ক্ষেত্রে বােরন পরমাণুর বহিঃস্তরে 6 টি ইলেকট্রন অর্জিত হয় অর্থাৎ অষ্টক সংকোচন ঘটে। বােরন ও ফ্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ:
5 B = 1s2 2s1 2px1 2py1
9F = 1s2 2s2 2px2 2py2 2pz1
উপরের ইলেকট্রন বিন্যাস থেকে দেখা যায় যে, বােরন পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে 3টি বিজোড় ইলেকট্রন এবং ফ্লোরিন পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে 1 টি বিজোড় ইলেকট্রন আছে। বােরন পরমাণু তার সবচেয়ে বাহিরের শক্তিস্তরের তিনটি বিজোড় ইলেকট্রন তিনটি ফ্লোরিন পরমাণুর বিজোড় ইলেকট্রনের সাথে শেয়ার বা ভাগাভাগির মাধ্যমে তিনটি ইলেকট্রন জোড় গঠন করে। ফলে, BF3 অণুতে বােরন পরমাণুর সবচেয়ে বাহিরের শক্তিস্তরে 6টি ইলেকট্রন অর্জিত হয়। অর্থাৎ অষ্টক অপেক্ষা কম ইলেকট্রন অর্জিত হয়। ফলে , BF3 অণুতে বােরন পরমাণুর অষ্টক সংকোচন ঘটে।

চিত্র : BF3 অণুর বন্ধন গঠন
আরো কিছু যৌগে অষ্টক সংকোচন দেখা যায়।যেমন :

নিচের যৌগে অষ্টক সংকোচন ব্যাখ্যা করো ।
AlCl3, BeCl2 ,BeF2, BCl3 , BF3
‘দুই’ এর নিয়ম কাকে বলে?
অণু গঠনে কোনাে পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন বিদ্যমান থাকবে, এটিই হচ্ছে ‘দুই’ এর নিয়ম। অর্থাৎ অণুতে যেকোনাে পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন অবস্থান করবে।
যেমন: BeCl2 অণুর কেন্দ্রীয় পরমাণু Be এর সর্বশেষ শক্তিস্তরে 2 জোড়া অর্থাৎ 4টি ইলেকট্রন বিদ্যমান। BF3 অণুর কেন্দ্রীয় পরমাণু B এর সর্বশেষ শক্তিস্তরে 3 জোড়া অর্থাৎ 6টি ইলেকট্রন বিদ্যমান। CH4 অণুর কেন্দ্রীয় পরমাণু C এর সর্বশেষ শক্তিস্তরে 4 জোড়া অর্থাৎ ৪টি ইলেকট্রন বিদ্যমান। শুধু তাই নয় কেন্দ্রীয় পরমাণু ছাড়াও অন্য পরমাণুগুলাে অর্থাৎ Cl এর সর্বশেষ শক্তিস্তরে 4 জোড়া অর্থাৎ ৪টি ইলেকট্রন বিদ্যমান। F সর্বশেষ শক্তিস্তরে 4 জোড়া অর্থাৎ ৪টি ইলেকট্রন বিদ্যমান এবং H এর সর্বশেষ শক্তিস্তরে 1 জোড়া অর্থাৎ 2টি ইলেকট্রন বিদ্যমান। এক্ষেত্রে সকল পরমাণু ‘দুই’ এর নিয়ম অনুসরণ করেছে।
BF3 অণুর বন্ধন গঠন ব্যাখ্যায় অষ্টক নিয়ম অপেক্ষা দুই এর নিয়ম অধিক কার্যকর -ব্যাখ্যা করো ।
আমরা জানি,অণু গঠনকালে কোনাে মৌল ইলেকট্রন গ্রহণ, বর্জন অথবা ভাগাভাগির মাধ্যমে তার সর্বশেষ শক্তিস্তরে ৪টি করে ইলেকট্রন ধারণের মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ করে। একেই ‘অষ্টক’ নিয়ম বলা হয়।
বোরন ট্রাই ফ্লোরাইড (BF3 ) অণুর ক্ষেত্রে বােরন পরমাণুর বহিঃস্তরে 6 টি ইলেকট্রন অর্জিত হয় অর্থাৎ অষ্টক সংকোচন ঘটে। বােরন ও ফ্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ:
5 B = 1s2 2s1 2px1 2py1
9F = 1s2 2s2 2px2 2py2 2pz1
উপরের ইলেকট্রন বিন্যাস থেকে দেখা যায় যে, বােরন পরমাণুর বহিঃস্তরে 3টি বিজোড় ইলেকট্রন এবং ফ্লোরিন পরমাণুর বহিঃস্তরে 1 টি বিজোড় ইলেকট্রন আছে। বােরন পরমাণু তার বহিঃস্তরের তিনটি বিজোড় ইলেকট্রন তিনটি ফ্লোরিন পরমাণুর বিজোড় ইলেকট্রনের সাথে শেয়ার বা ভাগাভাগির মাধ্যমে তিনটি ইলেকট্রন জোড় গঠন করে। ফলে, BF3 অণুতে বােরন পরমাণুর বহিঃস্তরে 6টি ইলেকট্রন অর্জিত হয়।

চিত্র : BF3 অণুর বন্ধন গঠন
অর্থাৎ অষ্টক অপেক্ষা কম ইলেকট্রন অর্জিত হয়। ফলে , BF3 অণুতে বােরন পরমাণুর অষ্টক সংকোচন ঘটে। ইহা অষ্টক নিয়মের ব্যতিক্রম অর্থাৎ অষ্টক নিয়মের BF3 অণুর বন্ধন গঠন পুরোপরি ব্যাখ্যা করা যায়না ।
“অষ্টক’ নিয়মের কিছু সীমাবদ্ধতার কারণে বিজ্ঞানীরা নতুন একটি নিয়মের উপস্থাপন করেন। যাকে ‘দুই’ এর নিয়ম বলা হয়। দুই এর নিয়মটি অষ্টক নিয়ম থেকে অধিকতর উপযােগী এবং আধুনিক। নিষ্ক্রিয় গ্যাসগুলাের সর্বশেষ শক্তিস্তরে যেমন 2টি বা ৪টি ইলেকট্রন বিদ্যমান, তেমনি অণু গঠনে কোনাে পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন বিদ্যমান থাকবে, এটিই হচ্ছে ‘দুই’ এর নিয়ম। অর্থাৎ অণুতে যেকোনাে পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন অবস্থান করবে।
BF3 অণুর কেন্দ্রীয় পরমাণু B এর সর্বশেষ শক্তিস্তরে 3 জোড়া অর্থাৎ 6টি ইলেকট্রন বিদ্যমান। শুধু তাই নয় কেন্দ্রীয় পরমাণু ছাড়াও অন্য পরমাণুগুলাে অর্থাৎ F সর্বশেষ শক্তিস্তরে 4 জোড়া অর্থাৎ ৪টি ইলেকট্রন বিদ্যমান । এক্ষেত্রে সকল পরমাণু ‘দুই’ এর নিয়ম অনুসরণ করেছে। অর্থাৎ BF3 অণুর বন্ধন গঠন ব্যাখ্যায় অষ্টক নিয়ম অপেক্ষা দুই এর নিয়ম অধিক কার্যকর।
BeCl2 অণুর বন্ধন গঠন ব্যাখ্যায় অষ্টক নিয়ম অপেক্ষা দুই এর নিয়ম অধিক কার্যকর -ব্যাখ্যা করো ।
PCl5 অণুর বন্ধন গঠন ব্যাখ্যায় অষ্টক নিয়ম অপেক্ষা দুই এর নিয়ম অধিক কার্যকর -ব্যাখ্যা করো ।
CH4 অণুর বন্ধন গঠন ব্যাখ্যায় অষ্টক নিয়ম ও দুই এর নিয়ম উভয় কার্যকর -ব্যাখ্যা করো ।
নিষ্ক্রিয় গ্যাস কি?
যে সকল গ্যাসীয় মৌল অধিকতর স্থিতিশীলত ইলেকট্রন বিন্যাসের কারণে রাসায়নিক বিক্রিয়ায় তথা রাসায়নিক বন্ধন গঠনে অংশগ্রহণ করে না, তাদেরকে নিষ্ক্রিয় গ্যাস বলে। পর্যায় সারণির গ্রুপ-18 তে অবস্থিত মৌলসমূহ যাদের সর্বশেষ শক্তিস্তরে ২টি (ns2)হিলিয়ামের ক্ষেত্রে ও ৪টি (ns2np6) করে ইলেকট্রন বিদ্যমান থাকে তাদেরকে নিষ্ক্রিয় গ্যাস বলে।
নিষ্ক্রিয় গ্যাস কয়টি ও কী কী ? এদের নিষ্ক্রিয় গ্যাস বলা হয় কেন ?
নিষ্ক্রিয় গ্যাস ৭টি। যথা: হিলিয়াম (He), নিয়ন (Ne), আর্গন (Ar), ক্রিপ্টন (Kr), জেনন (Xe), রেডন (Rn) ও অগানেসন (Og)
এদের সর্বশেষ শক্তিস্তরে দ্বিত্ব ও অষ্টক পূর্ণ থাকার কারণে নিষ্ক্রিয় গ্যাসগুলাে অধিকতর স্থিতিশীল হয়। অধিকতর স্থিতিশীলতার কারণে নিষ্ক্রিয় গ্যাসগুলাে অন্য কোনাে মৌলকে ইলেকট্রন প্রদান করে না। এমনকি অপর কোনাে মৌলের কাছ থেকে কোনাে ইলেকট্রন গ্রহণ বা ভাগাভাগিও করে না। এরা রাসায়নিকভাবে আসক্তিহীন হয়ে পড়ে বা এরা নিষ্ক্রিয় হয়ে পড়ে। আবার সাধারণ তাপমাত্রায় এরা গ্যাস হিসাবে অবস্থান করে । এজন্যই সামগ্রিকভাবে এদেরকে নিষ্ক্রিয় গ্যাস বলা হয় ।
নিষ্ক্রিয় গ্যাসসমূহের নিষ্ক্রিয়তার বা স্থিতিশীলতার কারণ ব্যাখ্যা কর।
নিষ্ক্রিয় গ্যাসসমূহের ইলেকট্রন বিন্যাস :
He (2): 1s2
Ne (10) : 1s2 2s2 2p6
Ar (18) : 1s2 2s2 2p6 3s2 3p6
Kr (36) : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6
Xe (54): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6
Rn (86) : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6
Og (118) : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f14 6s2 6p6 6d10 7s2 7p6
কোনাে মৌলের পরমাণুর সক্রিয়তা ,স্থিতিশীলতার বা নিষ্ক্রিয়তা নির্ভর করে ঐ মৌলের পরমাণুর সর্বশেষ কক্ষপথের ইলেকট্রন সংখ্যার উপর। নিষ্ক্রিয় গ্যাসসমূহের ইলেকট্রন বিন্যাসে দেখা যায় যে, হিলিয়ামের সর্বশেষ শক্তিস্তরে 2টি ইলেকট্রন রয়েছে। হিলিয়ামের বেলায় তার সর্বশেষ শক্তিস্তর পূর্ণ করতে 2টি ইলেকট্রনই প্রয়ােজন, কাজেই এই ইলেকট্রন বিন্যাস স্থিতিশীল। অন্যান্য নিষ্ক্রিয় গ্যাসের বেলায় তাদের সর্বশেষ শক্তিস্তরে ৪টি (ns2np6) করে ইলেকট্রন বিদ্যমান। কোনাে মৌলের সর্বশেষ শক্তিস্তরে ৪টি করে ইলেকট্রন থাকলে তারা সর্বাধিক স্থিতিশীলতা অর্জন করে। সর্বশেষ শক্তিস্তরে 2টি থাকলে তাকে দ্বিত্ব বলে আর ৪টি ইলেকট্রন থাকলে তাকে অষ্টক বলে। সর্বশেষ শক্তিস্তরে দ্বিত্ব ও অষ্টক পূর্ণ থাকার কারণে নিষ্ক্রিয় গ্যাসগুলাে অধিকতর স্থিতিশীল হয়। অধিকতর স্থিতিশীলতার কারণে নিষ্ক্রিয় গ্যাসগুলাে অন্য কোনাে মৌলকে ইলেকট্রন প্রদান করে না। এমনকি অপর কোনাে মৌলের কাছ থেকে কোনাে ইলেকট্রন গ্রহণ বা শেয়ারও করে না। এরা রাসায়নিকভাবে আসক্তিহীন হয়ে পড়ে বা এরা নিষ্ক্রিয় হয়ে পড়ে। অর্থাৎ এরা রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে না। আর এটিই এদের নিষ্ক্রিয়তার বা স্থিতিশীলতার মূল কারণ । এ কারণেই এদেরকে নিষ্ক্রিয় গ্যাস বলা হয়।
নিষ্ক্রিয় গ্যাস ছাড়া অন্য মৌলগুলো রাসায়নিক বিক্রিয়ায় অংশগ্রহণ করে কেন ? নিষ্ক্রিয় গ্যাস ছাড়া অন্য মৌলগুলো স্থিতিশীল হয় না কেন ?
নিষ্ক্রিয় গ্যাস ছাড়া বাকি কোনাে মৌলেরই সর্বশেষ শক্তিস্তরে দ্বিত্ব বা অষ্টক পূর্ণ থাকে না। ফলে তারা স্থিতিশীল হয় না। অন্যান্য মৌল স্থিতিশীলতা অর্জনের জন্য সর্বশেষ শক্তিস্তরে দ্বিত্ব বা অষ্টক পূরণ করতে চায়। এজন্য তারা সর্বশেষ শক্তিস্তরে ইলেকট্রন গ্রহণ, প্রদান অথবা ভাগাভাগি করে পরস্পরের সাথে বন্ধন গঠন করে।
রাসায়নিক বন্ধন গঠনের কারণ ব্যাখ্যা করো । রাসায়নিক বন্ধন কেন গঠিত হয়?
অণুতে পরমাণুসমূহ যে আকর্ষণের মাধ্যমে একে অপরের সাথে যুক্ত থাকে তাকেই রাসায়নিক বন্ধন বলে। বন্ধন সৃষ্টির মূল ভিত্তি হলাে মৌলসমূহের নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জনের চেষ্টা। হিলিয়ামের সর্বশেষ শক্তিস্তরে 2টি ইলেকট্রন রয়েছে। অন্যান্য নিষ্ক্রিয় গ্যাসের বেলায় তাদের সর্বশেষ শক্তিস্তরে ৪টি (ns2np6) করে ইলেকট্রন বিদ্যমান। প্রত্যেক মৌলই তার সর্বশেষ শক্তিস্তরে নিষ্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন বিন্যাস অর্থাৎ দ্বিত্ব ও অষ্টক অর্জনের চেষ্টা করে। একই মৌলের বা ভিন্ন মৌলের দুটি পরমাণু যখন কাছাকাছি অবস্থান করে তখন তারা তাদের সর্বশেষ শক্তিস্তরে ইলেকট্রন গ্রহণ, বর্জন বা ভাগাভাগির মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জন করে। এর মাধ্যমে তাদের মধ্যে একধরনের আকর্ষণের সৃষ্টি হয়, যে আকর্ষণকে রাসায়নিক বন্ধন বলা হয়। কাজেই বলা যেতে পারে রাসায়নিক বন্ধন গঠনের মূল কারণ হলাে পরমাণুগুলাের সর্বশেষ শক্তিস্তরের ইলেকট্রনগুলাে নিষ্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন বিন্যাস (দ্বিত্ব বা অষ্টক) লাভের প্রবণতা।
পরমাণু আধান বা চার্জ নিরপেক্ষ হয় কেন?
আমরা জানি, সাধারণ অবস্থায় পরমাণুর নিউক্লিয়াসে যতটি ধনাত্মক আধান বা পজিটিভ চার্জবিশিষ্ট প্রােটন থাকে এবং নিউক্লিয়াসের বাইরে বিভিন্ন শক্তিস্তরে ঠিক ততটি ঋণাত্মক আধান বা নেগেটিভ চার্জবিশিষ্ট ইলেকট্রন থাকে। এর ফলে পরমাণুটি সামগ্রিকভাবে আধান বা চার্জ নিরপেক্ষ হয়।
ক্যাটায়ন কাকে বলে?
ধনাত্মক আধান বা পজিটিভ চার্জ বিশিষ্ট আয়নকে ক্যাটায়ন বলে। যেমন : সােডিয়াম আয়ন (Na+), ক্যালসিয়াম আয়ন(Ca2+ ) ম্যাগনেসিয়াম আয়ন (Mg2+) ইত্যাদি।
একটি পরমাণু কীভাবে ক্যাটায়নে পরিণত হয় ?
একটি আধান নিরপেক্ষ পরমাণুর বাইরের শক্তিস্তর থেকে এক বা একাধিক ইলেকট্রনকে সরিয়ে নিলে অথবা পরমাণুটি ইলেক্ট্রন ত্যাগ করলে এটি আর আধান নিরপেক্ষ থাকবে না। এটি সামগ্রিকভাবে ধনাত্মক আধানবিশিষ্ট আয়নে অর্থাৎ ক্যাটায়নে পরিণত হবে।
কোন মৌলগুলো সাধারণত ক্যাটায়নের সৃষ্টি করে?
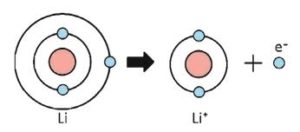
সাধারণত পর্যায় সারণির বামের মৌলসমূহ বা ধাতুগুলাে তাদের সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রন ত্যাগ করে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভের মাধ্যমে ক্যাটায়নের সৃষ্টি করে। যেমন: লিথিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের একটি ইলেকট্রন ছেড়ে দিয়ে নিষ্ক্রিয় গ্যাস হিলিয়ামের ইলেকট্রন বিন্যাস অর্জনের মাধ্যমে লিথিয়াম ক্যাটায়ন (Li+) তৈরি করে।
Li – e– = Li+
অনুরূপে, Na পরমাণু তার সর্বশেষ শক্তিস্তরের একটি ইলেকট্রন ত্যাগ করে নিষ্ক্রিয় গ্যাস Ne এর ইলেকট্রন বিন্যাস লাভের মাধ্যমে সােডিয়াম ক্যাটায়ন (Na+) তৈরি করে।
Na -e– = Na+
ধাতুসমূহ কেন তাদের সর্বশেষ শক্তিস্তরের ইলেকট্রন ছেড়ে দিয়ে ক্যাটায়ন তৈরি করে? ধাতুসমূহ কেন ক্যাটায়ন তৈরি করে?
আমরা জানি, পর্যায় সারণির যেকোনাে একটি পর্যায়ে বাম থেকে ডানে গেলে মৌলসমূহের ধাতব ধর্ম ধীরে ধীরে হ্রাস পায় এবং অধাতব ধর্ম বৃদ্ধি পায়। অর্থাৎ যেকোনাে পর্যায়ের বামের মৌলসমূহ হলাে ধাতু এবং ডানের মৌলসমূহ হলাে অধাতু। আবার একই পর্যায়ে বাম থেকে ডানে গেলে মৌলসমূহ আকারও ধীরে ধীরে হ্রাস পায়। এই কারণে একই পর্যায়ে অবস্থিত অন্য মৌলসমূহের চেয়ে ধাতুগুলাের আকার বড় হয়ে থাকে। আবার ধাতুগুলাের সর্বশেষ শক্তিস্তরে সাধারণত 1, 2 বা 3টি ইলেকট্রন থাকে। আকার বড় হওয়ার কারণে ধাতুগুলাের সর্বশেষ শক্তিস্তরের ইলেকট্রনগুলাের নিউক্লিয়াস থেকে দূরে থাকে এবং নিউক্লিয়াসের সাথে আকর্ষণ কম হয় অর্থাৎ দুর্বলভাবে আবদ্ধ থাকে। ফলে এদের আয়নিকরণ শক্তির মান অনেক কম হয়। অর্থাৎ সামান্য পরিমাণ শক্তি প্রয়ােগ করলেই ধাতুগুলাে তার সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রন ত্যাগ করে কাছাকাছি নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জন করে ক্যাটায়নে পরিণত হতে পারে। এই কারণেই ধাতুগুলােই মূলত ক্যাটায়নে পরিণত হয়।
যেমন : লিথিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের একটি ইলেকট্রন ছেড়ে দিয়ে নিষ্ক্রিয় গ্যাস হিলিয়ামের ইলেকট্রন বিন্যাস অর্জনের মাধ্যমে লিথিয়াম ক্যাটায়ন (Li+) তৈরি করে।
Li – e– = Li+
ধাতুসমূহ কেন অ্যানায়ন তৈরি করে না ?
আমরা জানি, পর্যায় সারণির যেকোনাে একটি পর্যায়ে বাম থেকে ডানে গেলে মৌলসমূহের ধাতব ধর্ম ধীরে ধীরে হ্রাস পায় এবং অধাতব ধর্ম বৃদ্ধি পায়। অর্থাৎ যেকোনাে পর্যায়ের বামের মৌলসমূহ হলাে ধাতু এবং ডানের মৌলসমূহ হলাে অধাতু। আবার একই পর্যায়ে বাম থেকে ডানে গেলে মৌলসমূহ আকারও ধীরে ধীরে হ্রাস পায়। এই কারণে একই পর্যায়ে অবস্থিত অন্য মৌলসমূহের চেয়ে ধাতুগুলাের আকার বড় হয়ে থাকে। আবার ধাতুগুলাের সর্বশেষ শক্তিস্তরে সাধারণত 1, 2 বা 3টি ইলেকট্রন থাকে। আকার বড় হওয়ার কারণে ধাতুগুলাের সর্বশেষ শক্তিস্তরের ইলেকট্রনগুলাের নিউক্লিয়াস থেকে দূরে থাকে এবং নিউক্লিয়াসের সাথে আকর্ষণ কম হয় অর্থাৎ দুর্বলভাবে আবদ্ধ থাকে। ফলে এদের আয়নিকরণ শক্তির মান অনেক কম হয়। অন্যভাবে বলা যায়, এদের ইলেকট্রন আসক্তির মান অনেক কম হয়। ফলে, এরূপ কোনাে মৌলের সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রন গ্রহণ করা কঠিন হয়ে পড়ে । অপরদিকে আয়নিকরণ শক্তির মান অনেক কম হওয়াই এরূপ কোনাে মৌলের সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রনকে সরিয়ে নিতে অনেক কম শক্তির প্রয়ােজন হয় । ফলে এরা সহজেই ইলেক্ট্রন ত্যাগ করে ক্যাটায়নে পরিণত হতে পারে কিন্তু অ্যানায়ন তৈরি করে না ।
অ্যানায়ন কাকে বলে?
ঋণাত্মক আধানবিশিষ্ট বা নেগেটিভ চার্জ বিশিষ্ট অধাতব পরমাণুকে অ্যানায়ন বলে। যেমন : ক্লোরাইড আয়ন (Cl–), অক্সাইড আয়ন (O2-) ইত্যাদি ।
একটি পরমাণু কীভাবে অ্যানায়নে পরিণত হয় ?
একটি আধান নিরপেক্ষ পরমাণুর বাইরের শক্তিস্তরে এক বা একাধিক ইলেকট্রন গ্রহণের ফলে এদের নিউক্লিয়াসে অবস্থিত ধনাত্মক প্রােটন সংখ্যার চেয়ে ঋণাত্মক আধানবিশিষ্ট ইলেকট্রনের সংখ্যা বেশি হয়। ফলে সামগ্রিকভাবে অধাতব পরমাণুসমূহ ঋণাত্মক আধানবিশিষ্ট অর্থাৎ অ্যানায়নে পরিণত হয়।
যেমন: ক্লোরিন (Cl) পরমাণু একটি ইলেকট্রন গ্রহণ করে নিস্ক্রিয় গ্যাস আর্গনের (Ar) ইলেকট্রন বিন্যাস লাভের মাধ্যমে ক্লোরাইড (Cl–) আয়ন তৈরি করে।
Cl + e– = Cl–
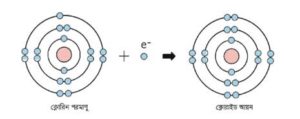
ঋণাত্মক Cl– আয়ন গঠন।
কোন মৌলগুলো সাধারণত অ্যানায়নে পরিণত হয় ?
সাধারণত পর্যায় সারণির ডানের মৌলসমূহ বা অধাতুগুলাে ইলেক্ট্রন গ্রহণের ফলে আনায়নে পরিণত হয় । এদের সর্বশেষ শক্তিস্তরে সাধারণত 5, 6 বা 7 টি ইলেকট্রন বিদ্যমান থাকে। যেহেতু এদের সর্বশেষ শক্তিস্তরে অষ্টক অপেক্ষা সাধারণত 1, 2 কিংবা 3টি ইলেকট্রন কম থাকে সেহেতু এরা সেই সংখ্যক ইলেকট্রন গ্রহণ করে সহজেই নিষ্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে এবং অ্যানায়নে পরিণত হয়।
অধাতুগুলাে ক্যাটায়ন তৈরি করে না কেন ?
অধাতুগুলাে পর্যায় সারণির ডানে অবস্থান করে। এদের সর্বশেষ শক্তিস্তরে সাধারণত 5, 6 বা 7 টি ইলেকট্রন বিদ্যমান থাকে। এদের আকার একই পর্যায়ের ধাতুসমূহের চেয়ে অনেক ছােট হয়। ছােট আকারের কারণে সর্বশেষ শক্তিস্তর নিউক্লিয়াসের কাছাকাছি থাকে এবং এদের সর্বশেষ শক্তিস্তরের ইলেকট্রনের প্রতি নিউক্লিয়াসের আকর্ষণ অনেক বেশি হয়, অর্থাৎ এদের আয়নিকরণ শক্তির মান অনেক বেশি হয়। এরূপ কোনাে মৌলের সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রনকে সরিয়ে নিতে অনেক বেশি শক্তির প্রয়ােজন হয়, যা সাধারণ অবস্থায় কোনাে রাসায়নিক বিক্রিয়া থেকে সহজে পাওয়া যায় না। এ কারণে অধাতুগুলাে সাধারণত ধনাত্মক আধান তথা ক্যাটায়ন তৈরি করে না।
অধাতুগুলাে অ্যানায়ন তৈরি করে কেন ? অধাতুসমূহ কেন তাদের সর্বশেষ শক্তিস্তরে ইলেকট্রন গ্রহণ করে অ্যানায়ন তৈরি করে?
অধাতুগুলাে পর্যায় সারণির ডানে অবস্থান করে। এদের সর্বশেষ শক্তিস্তরে সাধারণত 5, 6 বা 7 টি ইলেকট্রন বিদ্যমান থাকে। যেহেতু এদের সর্বশেষ শক্তিস্তরে অষ্টক অপেক্ষা সাধারণত 1, 2 কিংবা 3টি ইলেকট্রন কম থাকে সেহেতু এরা সেই সংখ্যক ইলেকট্রন গ্রহণ করে সহজেই নিষ্ক্রিয় গ্যাসের স্থিতিশীল ইলেকট্রন বিন্যাস লাভ করে। অন্যভাবে বলা যায়, এদের ইলেকট্রন আসক্তির মান বেশি। ইলেকট্রন গ্রহণের ফলে এদের নিউক্লিয়াসে অবস্থিত ধনাত্মক প্রােটন সংখ্যার চেয়ে ঋণাত্মক আধানবিশিষ্ট ইলেকট্রনের সংখ্যা বেশি হয়। ফলে সামগ্রিকভাবে অধাতব পরমাণুসমূহ ঋণাত্মক আধানবিশিষ্ট হয় অর্থাৎ অ্যানায়নে পরিণত হয় । এভাবে ঋণাত্মক আধানবিশিষ্ট অধাতব পরমাণুকে অ্যানায়ন বলে। যেমন: ক্লোরিন (Cl) পরমাণু একটি ইলেকট্রন গ্রহণ করে নিস্ক্রিয় গ্যাস আর্গনের (Ar) ইলেকট্রন বিন্যাস লাভের মাধ্যমে ক্লোরাইড (Cl–) আয়ন তৈরি করে। Cl + e– = Cl–
আয়ন কাকে বলে? আয়ন কত প্রকার ও কী কী?
ধনাত্বক বা ঋণাত্বক চার্জযুক্ত পরমাণুকে আয়ন বলে। যেমন : সোডিয়াম আয়ন (Na+), ক্লোরাইড আয়ন (Cl–), অক্সাইড আয়ন (O2-) ইত্যাদি।
আয়ন দুই প্রকার। যথা : ক্যাটায়ন ও অ্যানায়ন।
আয়ন কীভাবে সৃষ্টি হয় তা ব্যাখ্যা করো । আয়ন কেন সৃষ্টি হয় ?
আমরা জানি, সাধারণ অবস্থায় একটি পরমাণুর নিউক্লিয়াসে যতটি ধনাত্মক আধান বা পজিটিভ চার্জবিশিষ্ট প্রােটন থাকে, নিউক্লিয়াসের বাইরে বিভিন্ন শক্তিস্তরে ঠিক ততটি ঋণাত্মক আধান বা নেগেটিভ চার্জবিশিষ্ট ইলেকট্রন থাকে। এর ফলে পরমাণুটি সামগ্রিকভাবে আধান বা চার্জ নিরপেক্ষ হয়। অণু গঠন কালে দুটি পরমাণুর মধ্যে একটি পরমাণু হতে এক বা একাধিক ইলেকট্রন অপর পরমাণুতে সম্পূর্ণভাবে স্থানান্তরিত হয়। ইলেকট্রনের এরুপ স্থানান্তরের ফলে পরমাণুর মধ্যে প্রােটন ও ইলেকট্রন সংখ্যার পার্থক্য সৃষ্টি হয় । ফলে আয়নের সৃষ্টি হয়। সাধারণত কোনাে পরমাণু ইলেকট্রন ত্যাগ করলে ধনাত্বক আধানের সৃষ্টি হয় এবং ইলেকট্রন গ্রহণ করলে ঋণাত্বক আধানের সৃষ্টি হয়।
যেমন : সােডিয়াম পরমাণুতে 11টি প্রােটন ও 11টি ইলেকট্রন আছে এবং ক্লোরিণ পরমাণুতে 17টি প্রােটন ও 17টি ইলেকট্রন আছে। অণু গঠন কালে Na পরমাণু Cl পরমাণুতে একটি ইলেকট্রন দান করে। ফলে Na পরমাণু Na+ আয়নে এবং Cl পরমাণু Cl– আয়নে পরিণত হয়।
Na → Na+ + e–
Cl → Cl– -e–
সােডিয়াম Na+ আয়ন গঠন করলেও Na2+ আয়ন গঠন করে না -ব্যাখ্যা কর।
সােডিয়ামের পারমাণবিক সংখ্যা 11 এবং এর ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s1। ইলেকট্রন বিন্যাস হতে দেখা যায় যে, সােডিয়াম পরমাণুর সর্বশেষ কক্ষপথে 1 টি মাত্র ইলেকট্রন বিদ্যমান।সোডিয়াম পরমাণু এই 1 টি ইলেক্ট্রনটি ত্যাগ করে সোডিয়াম আয়ন এ পরিণত হয়। সােডিয়াম পরমাণুর প্রথম আয়নিকরণ শক্তি অপেক্ষা দ্বিতীয় আয়নিকরণ শক্তির মান অনেক বেশি। এজন্য Na+ আয়নের সর্বশেষ কক্ষপথে হতে আরও একটি ইলেকট্রন অপসারণ করে Na2+ আয়ন গঠন সম্ভব নয়। কারণ একটি ইলেকট্রন ত্যাগের ফলে যে নিষ্ক্রিয় গ্যাস কাঠামাের সৃষ্টি হয় তা অত্যন্ত স্থিতিশীল। সুতরাং Na+ থেকে আর কোনো ইলেক্ট্রনকে অপসারণ করা যায় না তাই সােডিয়ামের জারণ সংখ্যা +1 । আর এজন্য সােডিয়াম Na+ আয়ন গঠন করলেও Na2+ আয়ন গঠন করে না।
পরমাণু ও আয়নের মধ্যে পার্থক্য দেখাও ।
পরমাণু ও আয়নের মধ্যে পার্থক্য:
| পরমাণু | আয়ন |
| মৌলিক পদার্থের ক্ষুদ্রতম কণাকে পরমাণু বলে । | ধনাত্বক বা ঋণাত্বক চার্জযুক্ত পরমাণুকে আয়ন বলে। |
| পরমাণু তড়িৎ বা চার্জ নিরপেক্ষ । | আয়ন ধনাত্বক বা ঋণাত্বক চার্জযুক্ত । |
| পরমাণুতে ইলেকট্রন ও প্রােটন সংখ্যা সমান। | আয়নে ইলেকট্রন সংখ্যা প্রােটন অপেক্ষা হয় কম বা না হয় বেশি থাকে। |
| পরমাণু আয়নের চেয়ে কম স্থিতিশীল। | আয়ন পরমাণুর চেয়ে বেশি স্থিতিশীল। |
| পরমাণু হলো রাসায়নিক বিক্রিয়ার পূর্বের অবস্থা। | আয়ন হলো রাসায়নিক বিক্রিয়ার পরের অবস্থা। |
আয়নিক বন্ধন কাকে বলে?
যে আকর্ষণের ফলে ক্যাটায়ন ও অ্যানায়ন পরস্পরের সাথে যুক্ত থাকে তাকে আয়নিক বা তড়িৎযােজী বন্ধন বলে ।
অর্থাৎ ধাতব ও অধাতব পরমাণুর রাসায়নিক সংযােগের সময় ধাতব পরমাণু তার সর্বশেষ শক্তিস্তরের এক বা একাধিক ইলেকট্রনকে অধাতব পরমাণুর সর্বশেষ শক্তিস্তরে স্থানান্তর করে যথাক্রমে ধনাত্মক ও ঋণাত্মক আয়ন সৃষ্টির মাধ্যমে যে বন্ধন গঠিত হয় তাকে আয়নিক বা তড়িৎযােজী বন্ধন বলে।
NaCl এর বন্ধন গঠন ডায়াগ্রাম বা চিত্রসহ বর্ণনা কর।
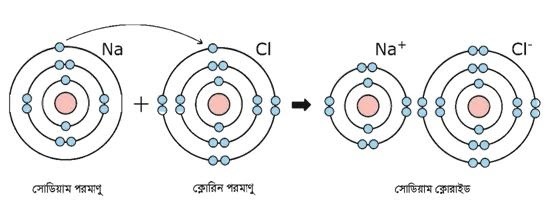
NaCl এর মধ্যে আয়নিক বন্ধন বিদ্যমান। সােডিয়াম ও ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ –
11 Na = 1s2 2s2 2p6 3s1
17 Cl = 1s2 2s2 2p6 3s2 3p5
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, সােডিয়াম পরমাণুর সর্বশেষ শক্তিস্তরে 1টি ইলেকট্রন এবং ক্লোরিন পরমাণুর সর্বশেষ 7টি ইলেকট্রন রয়েছে। সােডিয়াম ক্লোরাইড অণু গঠনকালে সােডিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের 1 টি ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাস নিয়নের মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে Na+ ক্যাটায়নে পরিণত হয়। অপরদিকে Cl পরমাণু তার সর্বশেষ শক্তিস্তরের Na এর ত্যাগকৃত ইলেকট্রনটিকে গ্রহণ করে নিকটতম নিষ্ক্রিয় গ্যাস আর্গনের মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে Cl– অ্যানায়নে পরিণত হয়। এভাবে সৃষ্ট ধনাত্মক আধান Na+ ও ঋণাত্মক আধান Cl– পরস্পরের সাথে স্থির বৈদ্যুতিক আকর্ষণে আবদ্ধ হয় এবং এভাবেই NaCl যৌগের সৃষ্টি হয়।
Na → Na+ + e–
Cl + e– → Cl–
Na + Cl → Na+ + Cl– = NaCl
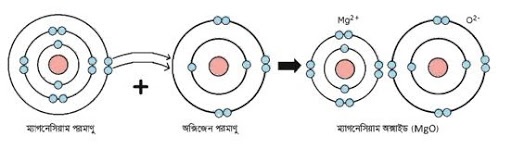
MgO অণুর বন্ধন গঠন ডায়াগ্রামের বা চিত্রের সাহায্যে ব্যাখ্যা কর।
MgO এর মধ্যে আয়নিক বন্ধন বিদ্যমান। ম্যাগনেসিয়াম ও অক্সিজেন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ:
12 Mg = 1s2 2s2 2p6 3s2
8 O = 1s2 2s2 2p4
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, ম্যাগনেসিয়াম পরমাণুর ম্যাগনেসিয়াম পরমাণুর সর্বশেষ শক্তিস্তরে 2 টি ইলেকট্রন এবং অক্সিজেন পরমাণুর সর্বশেষ শক্তিস্তরে 6 টি ইলেকট্রন রয়েছে। ম্যাগনেসিয়াম অক্সাইড অণু গঠনের সময় ম্যাগনেসিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের 2 টি ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাস Ne এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে Mg2+ এ পরিণত হয়। Mg → Mg2+ + 2e–
আবার O পরমাণু ঐ 2টি ইলেকট্রন গ্রহণ করে নিষ্ক্রিয় গ্যাস Ne এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে O2- এ পরিণত হয়।
O + 2e– → O2-
Mg + O → Mg2+ + O2- → MgO
এবার এই বিপরীত আধানযুক্ত Mg2+ এবং O2- আয়নদ্বয় কাছাকাছি এসে পরস্পরের সাথে স্থির বৈদ্যুতিক আকর্ষণে আবদ্ধ হয় এবং এভাবেই MgO যৌগের অণু গঠিত হয়।
CaF2 এর বন্ধন গঠন ডায়াগ্রামের বা চিত্রের সাহায্যে ব্যাখ্যা কর।
CaF2 এর মধ্যে আয়নিক বন্ধন বিদ্যমান। ক্যালসিয়াম ও ফ্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ :
20 Ca = 1s2 2s2 2p6 3s2 3p6 4s2
9 F = 1s2 2s2 2p5
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, ক্যালসিয়াম পরমাণর সর্বশেষ শক্তিস্তরে দ2 টি ইলেকটন এবং ফোরিন পরমাণুর সর্বশেষ শক্তিস্তরে 7 টি ইলেকট্রন রয়েছে। ক্যালসিয়াম ফ্লোরাইড অণু গঠনের সময় ক্যালসিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের 2 টি ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাস আর্গনের এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে Ca2+ এ পরিণত হয়।
Ca – 2e– → Ca2+
অপরদিকে দুটি ফ্লোরিন পরমাণু ঐ দুটি ইলেকট্রন গ্রহণ করে নিকটতম নিষ্ক্রিয় গ্যাস নিয়নের মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে ঋণাত্বক F– আয়নে পরিণত হয়। 2F + 2e– → 2F–
Ca + 2F → Ca2+ + 2F– → CaF2
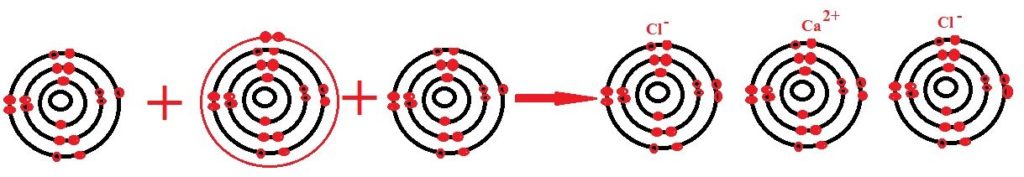
এই বিপরীত আধানযুক্ত Ca2+ ও 2F– আয়নসমূহ কাছাকাছি এসে পরস্পরের সাথে স্থির বৈদ্যুতিক আকর্ষণে আবদ্ধ হয় ।ফলে CaF2 যৌগের অণু গঠিত হয়।
Na2O এর বন্ধন গঠন ডায়াগ্রামের বা চিত্রের সাহায্যে ব্যাখ্যা কর।
Na2O এর মধ্যে আয়নিক বন্ধন বিদ্যমান। সােডিয়াম ও ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ –
11 Na = 1s2 2s2 2p6 3s1
8 O = 1s2 2s2 2p4
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, সােডিয়াম পরমাণুর সর্বশেষ শক্তিস্তরে 1 টি ইলেকট্রন এবং অক্সিজেন পরমাণুর সর্বশেষ 6 টি ইলেকট্রন রয়েছে।সােডিয়াম অক্সাইড অণু গঠনকালে ২ টি সােডিয়াম পরমাণু তার সর্বশেষ শক্তিস্তরের একটি করে মোট ২ টি ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাস নিয়নের মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ প্রত্যেকটি পরমাণু সর্বশেষ শক্তিস্তরে ৪টি করে ইলেকট্রন গঠন করে ২টি Na+ ক্যাটায়নে পরিণত হয়।
2Na → 2Na+ + 2e–
আবার O পরমাণু ঐ 2টি ইলেকট্রন গ্রহণ করে নিষ্ক্রিয় গ্যাস Ne এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে O2- এ পরিণত হয়।
O + 2e– → O2-
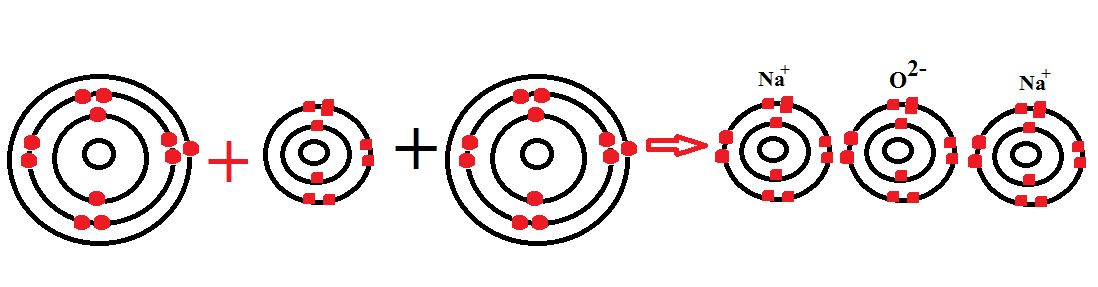
এই বিপরীত আধানযুক্ত 2Na+ ও O2- আয়নসমূহ কাছাকাছি এসে পরস্পরের সাথে স্থির বৈদ্যুতিক আকর্ষণে আবদ্ধ হয়। ফলে Na2O যৌগের সৃষ্টি হয়।
2Na + O=2Na+ + O2- = Na2O
নিচের যৌগগুলোর বন্ধন গঠন ডায়াগ্রামের বা চিত্রের সাহায্যে ব্যাখ্যা কর।
KF , KCl, NaF , MgF2, AlCl3, MgCl2, MgS
আয়নিক বন্ধন গঠনের শর্তাবলী উল্লেখ কর।
আয়নিক বন্ধন গঠনের শর্তাবলী :
(১) একটি ধাতু ও একটি অধাতুর মধ্যে আয়নিক বন্ধন গঠিত হয়। আয়নিক বন্ধন কখনও ধাতু-ধাতু বা অধাতু-অধাতু আয়নিক বন্ধন গঠিত হয় না। আয়নিক বন্ধন সর্বদা দুটি বিপরীতধর্মী আধানবিশিষ্ট পরনানুর মধ্যে গঠিত হয়।
(২) পরমাণুগুলাের একটির আয়নিকরণ শক্তি কম হতে হবে যাতে খুব কম শক্তি প্রয়ােগেই এর যােজ্যতা স্তর থেকে ইলেকট্রন অপসারণ সম্ভব হয়। অপর পরমাণুর ইলেকট্রন আসক্তি অধিক হতে হবে যাতে পরমাণুটির যােজ্যতা স্তর অতি সহজেই ইলেকট্রন গ্রহণ করতে পারে।
(৩) ধাতব পরমাণুর সর্ববহিস্থ শক্তিস্তরে একটি, দুইটি বা তিনটি ইলেকট্রন থাকতে হবে এবং অধাতব পরমাণুর সর্ববহিস্থ শক্তিস্তরে অষ্টক অপেক্ষা একটি, দুইটি বা তিনটি ইলেকট্রন কম থাকতে হবে।
(৪) ধাতুর পরমাণুকে ইলেক্ট্রন ত্যাগ করে ক্যাটায়ন এবং অধাতুর পরমাণুকে সেই ইলেক্ট্রন গ্রহণ করে অ্যানায়ন এ পরিণত হতে হবে।
4Be ও 12Mgএর যােজনী একই কেন? ব্যাখ্যা কর।
Be এবং Mg উভয়েই ধাতব মৌল। ধাতব মৌলের ক্ষেত্রে সর্বশেষ কক্ষপথের ইলেকট্রন সংখ্যাকে মৌলের যােজনী বলে। Be এবং Mg এর ইলেকট্রন বিন্যাস:
Be(4) → 1s2 2s2
Mg(12) → 1s2 2s22p63s2
উভয় মৌলের সর্বশেষ শক্তিস্তরে ২টি করে ইলেকট্রন বিদ্যমান। তাই উভয় মৌলের যােজনী একই অর্থাৎ ২।
জারণ সংখ্যা ও যােজনী মধ্যে পার্থক্য লিখ।
জারণ সংখ্যা ও যােজনী মধ্যে পার্থক্য নিম্নরূপ:
| জারণ সংখ্যা | যােজনী |
| ১. জারণ সংখ্যা হলাে এমন একটি সংখ্যা, যা দ্বারা মৌলের পরমাণুতে সৃষ্ট তড়িৎ চার্জের প্রকৃতি ও সংখ্যামান উভয়ই প্রকাশ পায়। | ১. অপরদিকে কোনাে মৌলের যােজনী হলাে অপর মৌলের সাথে যুক্ত হওয়ার ক্ষমতা। |
| ২. জারণ সংখ্যা ধনাত্মক ও ঋণাত্মক হতে পারে। | ২. যােজনী একটি পূর্ণ সংখ্যা। |
| ৩. জারণ সংখ্যা শূন্য ও ভগ্নাংশ হতে পারে | ৩. যােজনী কখনও শূন্য ও ভগ্নাংশ হতে পারে না। |
হিলিয়ামের যােজনী শূন্য কেন?
আমরা জানি, কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ কক্ষপথে যত সংখ্যক ইলেকট্রন থাকে অথবা যত সংখ্যক বিজোড় ইলেকট্রন থাকে তাকে মৌলের যােজনী বলে। আবার কোনাে মৌলের ইলেকট্রন বিন্যাসে সর্বশেষ শক্তিস্তর ইলেকট্রন দ্বারা পূর্ণ( দ্বিত্ব ও অষ্টক পূর্ণ) হলে মৌলের যােজনী হয় শূন্য । হিলিয়ামের ইলেকট্রন বিন্যাস He(2)=1s2
যেহেতু হিলিয়ামের ইলেকট্রন বিন্যাস হতে দেখা যায় যে, এর সর্বশেষ শক্তিস্তর দুটি ইলেকট্রন দ্বারা পূর্ণ বা দ্বিত্ব পূর্ণ । তাই হিলিয়ামের যােজনী শূন্য।
AlCl3 এর বন্ধন গঠন ডায়াগ্রামের বা চিত্রের সাহায্যে ব্যাখ্যা কর।
AlCl3 এর মধ্যে আয়নিক বন্ধন বিদ্যমান। অ্যালুমিনিয়াম ও ক্লোরিন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ :
13 Al = 1s2 2s2 2p6 3s2 3p1
17 Cl = 1s2 2s2 2p6 3s2 3p5
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, অ্যালুমিনিয়াম পরমাণর সর্বশেষ শক্তিস্তরে 3 টি ইলেকটন এবং ক্লোরিন পরমাণুর সর্বশেষ শক্তিস্তরে সাতটি ইলেকট্রন রয়েছে। ক্যালসিয়াম ক্লোরাইড অণু গঠনকালে ক্যালসিয়াম পরমাণ তার সর্বশেষ শক্তিস্তরের 3 টি ইলেকট্রন ত্যাগ করে নিকটতম নিষ্ক্রিয় গ্যাস নিয়নের এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে Al3+ এ পরিণত হয়।
Al – 3e– → Al3+
অপরদিকে 3 টি ক্লোরিন পরমাণু ঐ 3 টি ইলেকট্রন গ্রহণ করে নিকটতম নিষ্ক্রিয় গ্যাস আর্গন এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে ঋণাতৃক Cl– আয়নে পরিণত হয়। 3Cl + 3e– → 3F–
Al + 3Cl → Al3+ + 3Cl– → AlCl3
এই বিপরীত আধানযুক্ত Al3+ ও 3F– আয়নসমূহ কাছাকাছি এসে পরস্পরের সাথে স্থির বৈদ্যুতিক আকর্ষণে আবদ্ধ হয় । ফলে AlCl3 যৌগের সৃষ্টি হয়।
সমযােজী বন্ধন কাকে বলে?
ইলেকট্রন শেয়ারের মাধ্যমে দুটি অধাতব পরমাণুর মধ্যে যে বন্ধন গঠিত হয়, তাকে সমযােজী বন্ধন বলে।
সমযােজী যৌগ কাকে বলে ?
যে যৌগে সমযােজী বন্ধন থাকে তাকে সমযােজী যৌগ বলে।
প্রতিটি সমযােজী বন্ধনে কয়টি ইলেকট্রন অংশগ্রহণ করে ?
প্রতিটি সমযােজী বন্ধনে দুটি ইলেকট্রন অংশগ্রহণ করে।
সমযােজী বন্ধনকে এবং ইলেকট্রনসমূহকে কিসের মাধ্যমে প্রকাশ করা হয়?
সমযােজী বন্ধনকে একটি রেখার (-) মাধ্যমে প্রকাশ করা হয় এবং ইলেকট্রনসমূহকে ডট (.) চিহ্ন বা ক্রস (x) চিহ্ন দ্বারা প্রকাশ করা হয়।
উদাহরণসহ সমযােজী বন্ধন ব্যাখ্যা কর।
দুটি অধাতব পরমাণুর রাসায়নিক সংযােগের সময় অধাতব পরমাণুদ্বয় তাদের সর্বশেষ শক্তিস্তরের (এক বা একাধিক) একটি ইলেকট্রনকে সরবরাহ করে এক জোড়া ইলেকট্রন তৈরি করে। এরপর এই এক জোড়া ইলেকট্রন উভয় পরমাণু শেয়ারের মাধ্যমে যে বন্ধন গঠিত হয় তাকে সমযােজী বন্ধন বলে। যেমন –
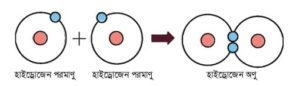
H2 অণুতে সমযােজী বন্ধন: হাইড্রোজেন পরমাণুর ইলেকট্রন বিন্যাস হলাে, H(1) → 1s1। দুটি হাইড্রোজেন পরমাণু যখন কাছাকাছি আসে তখন উভয় পরমাণুই একটি করে ইলেকট্রন শেয়ার করে নিষ্ক্রিয় গ্যাস এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে 2টি ইলেকট্রন গঠন করে। এর ফলে (H – H) সমযােজী বন্ধনের সৃষ্টি হয়।
H×+ H•→ H× •H → H- H
সমযােজী বন্ধন গঠনের শর্তাবলী কী কী ?
১) সাধারণত সমধর্মী মৌল যেমন অধাতু-অধাতু সমযােজী বন্ধন গঠনের মাধ্যমে যৌগ সৃষ্টি হয়।
২) গ্যাসীয় মৌলিক অণুসমূহ সমযােজী বন্ধনের মাধ্যমে সৃষ্টি হয়।
৩) উভয় অধাতব পরমাণু সমান সংখ্যক ইলেকট্রন শেয়ার করে এক বা একাধিক ইলেকট্রন জোড় সৃষ্টি করে এবং উভয় পরমাণু তা সমভাবে শেয়ার করে।
৪)যেসব পরমাণুর তড়িৎ ঋণাত্বকতার মান সমান অথবা তড়িৎ ঋণাত্বকতার পার্থক্য কম থাকে, সেসব পরমাণু সমযােজী বন্ধনে আবদ্ধ হয়ে সমযােজী অণু গঠন করে।
সমযােজী বন্ধন কত প্রকার ও কি কি?
ইলেকট্রন শেয়ারের উপর ভিত্তি করে সমযােজী বন্ধন তিন প্রকার। যথা- (১) একক বন্ধন (২) দ্বিবন্ধন ও (৩) ত্ৰিবন্ধন
(১) একক বন্ধন: নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জনের জন্য দুটি অধাতব পরমাণুর প্রত্যেকে একটি করে ইলেকট্রন শেয়ার করে যে সমযােজী বন্ধন গঠন করে তাকে একক বন্ধন বলে। যেমন –H2 অণুতে সমযােজী বন্ধন: হাইড্রোজেন পরমাণুর ইলেকট্রন বিন্যাস হলাে, H(1) → 1s1। দুটি হাইড্রোজেন পরমাণু যখন কাছাকাছি আসে তখন উভয় পরমাণুই একটি করে ইলেকট্রন শেয়ার করে নিষ্ক্রিয় গ্যাস এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে 2টি ইলেকট্রন গঠন করে। এর ফলে (H – H) সমযােজী বন্ধনের সৃষ্টি হয়।
H×+ H•→ H× •H → H- H
(২) দ্বিবন্ধন: নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জনের জন্য দুটি অধাতব পরমাণুর প্রত্যেকে এক জোড়া(দুইটি করে ) ইলেকট্রন শেয়ার করে যে সমযােজী বন্ধন গঠন করে তাকে দ্বি-বন্ধন বলে। যেমন –
O2 অণুতে সমযােজী বন্ধন: অক্সিজেন পরমাণুর ইলেকট্রন বিন্যাস হলাে, O(৪) → 1s22s22p4। অক্সিজেন পরমাণুর সর্বশেষ শক্তিস্তরে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস (অষ্টক) অপেক্ষা দুটি ইলেকট্রন 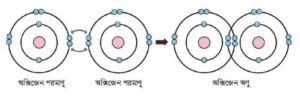
চিত্র : অক্সিজেন অণুতে সমযােজী বন্ধন গঠন।
কম আছে। এরূপ দুটি অক্সিজেন পরমাণু কাছাকাছি এলে তাদের উভয় পরমাণুই দুটি করে মােট চারটি ইলেকট্রন শেয়ার করায় সমযােজী বন্ধন গঠন করে এবং নিষ্ক্রিয় গ্যাস এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে। ফলে তাদের মধ্যে (O=O) সমযােজী বন্ধন গঠিত হয়। এক্ষেত্রে উভয় পরমাণু দুটি করে মােট চারটি ইলেকট্রন শেয়ার করায় সমযােজী বন্ধনের সংখ্যা হয় 2 (দুই)। যেমন:
সাধারণভাবে, O + O → O = O বা O2
(৩) ত্ৰিবন্ধন: নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জনের জন্য দুটি পরমাণুর প্রত্যেকে তিনটি করে ইলেকট্রন শেয়ার করে যে সমযােজী বন্ধন গঠন করে তাকে ত্রি-বন্ধন বলে। যেমন –
N2 অণুতে সমযােজী বন্ধন:
নাইট্রোজেন পরমাণুর ইলেকট্রন বিন্যাস হলাে, N(7) → 1s22s22p3। নাইট্রোজেন পরমাণুর সর্বশেষ শক্তিস্তরে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস (অষ্টক) অপেক্ষা তিনটি ইলেকট্রন কম আছে।
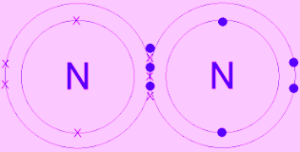
এরূপ দুটি নাইট্রোজেন পরমাণু কাছাকাছি এলে তাদের উভয় পরমাণুই তিনটি করে মােট ছয়টি ইলেকট্রন শেয়ার করে সমযােজী বন্ধন গঠন করে এবং নিষ্ক্রিয় গ্যাস এর মতাে ইলেকট্রন বিন্যাস অর্জন করে অর্থাৎ সর্বশেষ শক্তিস্তরে ৪টি ইলেকট্রন গঠন করে। ফলে তাদের মধ্যে( N≡ N )সমযােজী বন্ধন গঠিত হয়। এক্ষেত্রে উভয় পরমাণু তিনটি করে মােট ছয়টি ইলেকট্রন শেয়ার করায় সমযােজী বন্ধনের সংখ্যা হয় ৩ (তিন )। যেমন: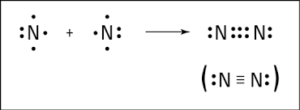
পানির অণুর সমযােজী বন্ধন গঠন/বন্ধন গঠন চিত্রসহ বর্ণনা করো ।
পানির একটি অণু দুইটি হাইড্রোজেন ও একটি অক্সিজেন পরমাণুর সমন্বয়ে গঠিত এবং এতে সমযােজী বন্ধন বিদ্যমান। হাইড্রোজেন পরমাণু এবং অক্সিজেন পরমাণুর ইলেকট্রন বিন্যাস নিম্নরূপ :
H=1s1
O= 1s2 2s2 2px2 2py1 2pz1
ইলেকট্রন বিন্যাস হতে দেখা যায় যে, হাইড্রোজেন পরমাণুর সর্বশেষ শক্তিস্তরে একটি বিজোড় ইলেক্ট্রন এবং অক্সিজেন পরমাণুর সর্বশেষ শক্তিস্তরে দুইটি বিজোড় ইলেকট্রন বিদ্যমান। নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস অর্জনের জন্য একটি অক্সিজেন পরমাণু তার সর্বশেষ শক্তিস্তরের দুইটি বিজোড় ইলেকট্রন দুইটি হাইড্রোজেন পরমাণুর বিজোড় ইলেকট্রনের সাথে শেয়ার করে দুইটি (O-H) বন্ধন গঠন করে। ফলে অক্সিজেন পরমাণু নিয়নের ইলেকট্রন বিন্যাস ( Ne= 1s2 2s2 2p6) এবং হাইড্রোজেন পরমাণু হিলিয়ামের ইলেকট্রন বিন্যাস (He= 1s2) অর্জন করে। এভাবেই পানির অণু গঠিত হয় ।
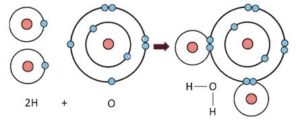
চিত্র: দুটি (O-H) সমযােজী বন্ধনের মাধ্যমে পানির অণুতে সমযােজী বন্ধন গঠন।
Thanks a lot sir.It was very helpful.❤
Welcome Anisha. I am very happy when a post helps someone. You can visit ALL POSTS for more help.
Thanks for this information.
Welcome Asif. Go to ALL POST to visit all the articles.