2016 সাল পর্যন্ত পৃথিবীতে মােট কতটি মৌলিক পদার্থ আবিষ্কৃত হয়েছে ?
2016 সাল পর্যন্ত পৃথিবীতে মােট 118টি মৌলিক পদার্থ আবিষ্কৃত হয়েছে।
পর্যায় সারণি (Periodic table):
পারমাণবিক সংখ্যার ক্রমানুসারে (ছােট থেকে বড় অনুযায়ী) প্রায় একই ধরনের ধর্মবিশিষ্ট মৌলসমূহকে একই শ্রেণীভুক্ত করে, আবিষ্কৃত সব মৌলকে স্থান দিয়ে মৌলসমূহের যে সারণি রচনা করা হয়, তাকে মৌলের পর্যায় সারণি বলা হয়।
পর্যায় কাকে বলে ?
পর্যায় সারণির বাম থেকে ডান পর্যন্ত বিস্তৃত সারিগুলােকে পর্যায় বলে।
গ্রুপ বা শ্রেণি বা স্তম্ব কাকে বলে?
পর্যায় সারণির উপর থেকে নিচ পর্যন্ত বিস্তৃত সারিগুলােকে গ্রুপ বা শ্রেণি কাকে বলে ।
পর্যায় সারণির পটভূমি (Background of Periodic Table)
কোন বিজ্ঞানী মৌলিক পদার্থসমূহকে ধাতু ও অধাতু এই দুই ভাগে ভাগ করেন?
1789 সালে ল্যাভয়সিয়ে অক্সিজেন, নাইট্রোজেন, হাইড্রোজেন, ফসফরাস, মার্কারি, জিংক এবং সালফার ইত্যাদি মৌলিক পদার্থসমূহকে ধাতু ও অধাতু এই দুই ভাগে ভাগ করেন।
ল্যাভয়সিয়ের সময় থেকেই মৌলগুলােকে বিভিন্ন ভাগে ভাগ করার চিন্তা-ভাবনা শুরু হয় কেন ?
ল্যাভয়সিয়ের সময় থেকেই মৌলগুলােকে বিভিন্ন ভাগে ভাগ করার চিন্তা-ভাবনা শুরু হয় যেন একই ধরনের মৌলিক পদার্থগুলাে একটি নির্দিষ্ট ভাগে থাকে।
ডােবেরাইনার ত্রয়ীসূত্র সূত্রটি লিখ।
ত্রয়ীসূত্র (Law of triads): তিনটি মৌলকে তাদের পারমাণবিক ভর অনুসারে সাজালে দ্বিতীয় মৌলের পারমাণবিক ভর প্রথম ও তৃতীয় মৌলের পারমাণবিক ভরের যােগফলের অর্ধেক বা তার কাছাকাছি, একে ডােবেরাইনারের ত্রয়ীসূত্র বলে। বিজ্ঞানী ডােবেরাইনার লক্ষ করেন তিনটি করে মৌলিক পদার্থ একই রকমের ধর্ম প্রদর্শন করে।
| মৌল | পারমাণবিক ভর | মৌল | পারমাণবিক ভর | মৌল | পারমাণবিক ভর |
| Ca | 40 | Li | 7 | Cl | 35.5 |
| Sr | 87 | Na | 23 | Br | 80 |
| Ba | 137 | K | 39 | I | 127 |
| Ca ও Ba এর পারমাণবিক ভরের গড় (40+137)/2 = 88.5 | Li ও K এর পারমাণবিক ভরের গড় ((7+39)/2 = 23 | Cl ও I এর পারমাণবিক ভরের গড় (35.5+127)/2 = 81.25 | |||
কত সালে বিজ্ঞানী ডােবেরাইনার ত্রয়ীসূত্র প্রকাশ করেন ?
1829 সালে বিজ্ঞানী ডােবেরাইনার ত্রয়ীসূত্র প্রকাশ করেন ।
বিজ্ঞানী ডােবেরাইনার কোন তিনটি মৌলকে প্রথম ত্রয়ী মৌল হিসেবে চিহ্নিত করেন?
বিজ্ঞানী ডডাবেরাইনার ক্লোরিন, ব্রোমিন ও আয়ােডিনকে প্রথম ত্রয়ী মৌল হিসেবে চিহ্নিত করেন।মৌল তিনটি কে “ডোবেরাইনার ত্রয়ী” বলা হয়।
ইংরেজ বিজ্ঞানী জন নিউল্যান্ড কতসালে অষ্টক সূত্র নামে একটি সূত্র প্রদান করেন?
1864 সাল পর্যন্ত আবিষ্কৃত মৌলসমূহের জন্য ইংরেজ বিজ্ঞানী জন নিউল্যান্ড অষ্টক সূত্র নামে একটি সূত্র প্রদান করেন।
নিউল্যান্ড অষ্টক সূত্রটি লেখো।
মৌলসমূহকে যদি পারমাণবিক ভরের ছােট থেকে বড় অনুযায়ী সাজানাে যায় তবে যেকোনাে একটি মৌলের ধর্ম তার অষ্টম মৌলের ধর্মের সাথে মিলে যায়। যেমন—
Li (7), Be (9.02), B (10.8) , C (12), N (14), O (16), F (19), Na (23), Mg (24), Al (27), Si (28), P (31), S (32),Cl (35.5), K (39), Ca (40)
উপরের তালিকা অনুসারে Li -কে প্রথম মৌল ধরে পরের অষ্টম মৌল হয় Na, আবার Na -কে প্রথম মৌল পরের অষ্টম মৌল হয় K । প্রকৃতপক্ষে দেখা যায় Li, Na এবং K -এর মধ্যে ভৌত ও রাসায়নিক ধর্মের অনেক মিল আছে— নিউল্য্যান্ড এই বিষয়টির নাম দেন অষ্টক সূত্র । এই সূত্রগুলি কিছু কিছু মৌলের ক্ষেত্রে প্রযোজ্য হলেও সমস্ত মৌলের ক্ষেত্রে সমানভাবে প্রযোজ্য হয় না । ফলে সূত্রগুলির নিজ নিজ কিছু সাফল্য থাকলেও সার্বজনীনভাবে স্বীকৃতি পায় নি ।
মেন্ডেলিফের পর্যায় সূত্র লেখো।
1869 সালে রাশিয়ান বিজ্ঞানী মেন্ডেলিফ সকল মৌলের ধর্ম পর্যালােচনা করে একটি পর্যায় সূত্র প্রদান করেন। সূত্রটি হলাে: “মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক ভর বৃদ্ধির সাথে পর্যায়ক্রমে আবর্তিত হয়”।
মেন্ডেলিফের পর্যায় সারণির সাফল্য:
1869 সালে রাশিয়ান বিজ্ঞানী মেন্ডেলিফ সকল মৌলের ধর্ম পর্যালােচনা করে একটি পর্যায় সূত্র প্রদান। করেন। সূত্রটি হলাে: “মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক ভর বৃদ্ধির সাথে পর্যায়ক্রমে আবর্তিত হয়”।
এ সূত্র অনুসারে তিনি তখন পর্যন্ত আবিষ্কৃত 63টি মৌলকে 12টি আনুভূমিক সারি আর ৪টি খাড়া কলামের একটি ছকে পারমাণবিক ভর বৃদ্ধি অনুসারে সাজিয়ে দেখান যে, একই কলাম বরাবর সকল মৌলগুলাের ধর্ম একই রকমের এবং একটি সারির প্রথম মৌল থেকে শেষ মৌল পর্যন্ত মৌলগুলাের ধর্মের ক্রমান্বয়ে পরিবর্তন ঘটে। এই ছকের নাম দেওয়া হয় পর্যায় সারণি ।
মেন্ডেলিফের পর্যায় সারণির আরেকটি সাফল্য হচ্ছে কিছু মৌলিক পদার্থের অস্তিত্ব সম্পর্কে সঠিক ভবিষ্যদ্বাণী। সে সময় মাত্র 63টি মৌল আবিষ্কৃত হওয়ার কারণে পর্যায় সারণির কিছু ঘর ফাঁকা থেকে যায়। মেন্ডেলিফ এই ফাঁকা ঘরগুলাের জন্য যে মৌলের ভবিষ্যদ্বাণী করেছিলেন পরবর্তীতে সেগুলাে সত্য প্রমাণিত হয়।
মেন্ডেলিফের পর্যায় সারণির কিছু ত্রুটিসমূহ:
মেন্ডেলিফের পর্যায় সারণির কিছু ত্রুটি পরিলক্ষিত হয়।মেন্ডেলিফের পর্যায় সূত্রটি হলাে: “মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক ভর বৃদ্ধির সাথে পর্যায়ক্রমে আবর্তিত হয়”। মেন্ডেলিফ পারমাণবিক ভর অনুযায়ী তার পর্যায় সারণিতে যে নিয়মানুযায়ী মৌলগুলাে বসিয়েছিলেন সেই নিয়মানুযায়ী যে পরমাণুর পারমাণবিক ভর কম থাকবে সেই পরমাণু পর্যায় সারণিতে আগে বসবে এবং যে পরমাণুর পারমাণবিক ভর বেশি থাকবে সেই পরমাণু পর্যায় সারণিতে পরে বসবে। কিন্তু একই ধরনের মৌলিক পদার্থকে একটি গ্রপে স্থান দিতে গিয়ে কয়েকটি মৌলকে তাদের পারমাণবিক ভর হিসেবে সাজানাে সম্ভব হয়নি। যেমন : পটাসিয়ামের পারমাণবিক ভর 39, আর্গনের পারমাণবিক ভর 40। পারমাণবিক ভর অনুসারে সাজালে পটাসিয়ামকে আর্গনের পূর্বে স্থান দিতে হয়, সে ক্ষেত্রে তার অবস্থান হয় নিষ্ক্রিয় গ্যাসসমূহের সাথে এবং আর্গনের স্থান হয় সােডিয়াম প্রভৃতি ক্ষারধাতুর সাথে। এতে পর্যায় সারাণর মূল উদ্দেশ্য ব্যাহত হয়। কারণ আর্গন একটি নিষ্ক্রিয় গ্যাস এবং পটাসিয়াম একটি ক্ষারধাতু। ফলে এ দুইটি মৌলকে পারমাণবিক ভর—ক্রমের বিপরীতে সাজানাে হয়। একইভাবে আয়ােডিনের পারমাণবিক ভর 127 এবং টেলুরিয়ামের ভর 127.6 হওয়া সত্ত্বেও ভৌত ও রাসায়নিক ধর্মের সামঞ্জস্যের কারণে আয়ােডিনকে টেলুরিয়ামের পরে স্থান দেওয়া হয়, যেন আয়ােডিন, ক্লোরিন ও ব্রোমিনের সাথে এবং টেলুরিয়াম, সালফার ও সেলেনিয়ামের সাথে একই গ্রুপভুক্ত হয়। এরকম আরও অনেক মৌলের ক্ষেত্রে দেখা যায় পারমাণবিক ভর বেশি হওয়া সত্ত্বেও তাদেরকে কোনাে কোনাে মৌলের আগে পর্যায় সারণিতে বসানাে হয়েছিল। এটি ছিল পর্যায় সারণির ত্রুটি। এরকম আরও অনেক ত্রুটি মেন্ডেলিফের পর্যায় সারণিতে লক্ষ করা যায়।
মেন্ডেলিফের পর্যায় সারণির ত্রুটিগুলাে কীভাবে সংশােধিত হয়?
1913 সালে মােসলে (Henry G. J. Moseley) কর্তৃক পারমাণবিক সংখ্যা আবিষ্কৃত হয়। তখন পারমাণবিক ভরের পরিবর্তে পারমাণবিক সংখ্যা অনুযায়ী মৌলগুলােকে পর্যায় সারণিতে সাজানাের প্রস্তাব দেন। এ সংখ্যা পর্যায় সারণিতে মৌলের ক্রমিক সংখ্যার সাথে মিলে যায় । এ কারণে পারমাণবিক সংখ্যাকে পর্যায় সারণির মূল ভিত্তি হিসেবে ধরা হয় এবং পর্যায় সূত্র নিম্নরুপে সংশােধিত হয় । মৌলসমূহের ভৌত ও রাসায়নিক ধর্মাবলি তাদের পারমাণবিক সংখ্যা অনুযায়ী পর্যায়ক্রমে আবর্তিত হয়। পারমাণবিক সংখ্যাকে ভিত্তি হিসেবে গ্রহণ করার পরে আর্গন-পটাসিয়াম, আয়ােডিন, টেলুরিয়াম প্রভৃতির স্থান নিয়ে আর কোনাে সমস্যা থাকে না। যেমন- পারমাণবিক সংখ্যা অনুসারে পর্যায় সারণিতে মৌলের স্থান দেওয়া হলে মেন্ডেলিফের পর্যায় সারণিতে আর্গনের পারমাণবিক সংখ্যা 18 এবং পটাশিয়াম-এর পারমাণবিক সংখ্যা 19। কাজেই আর্গন পটাশিয়ামের আগে বসবে। কাজেই পারমাণবিক সংখ্যা অনুসারে পর্যায় সারণিতে মৌলের স্থান দেওয়া হলে এই রকম ত্রুটিগুলাে সংশােধিত হয়। কিন্তু সহসা বিজ্ঞানীগণ অনুধাবন করেন যে, মৌলসমূহের ইলেকট্রন বিন্যাস হচ্ছে ধর্মাবলি পর্যায়ক্রমে আবর্তিত হওয়ার মূল ভিত্তি। উল্লেখ্য যে, একটি মৌলের ইলেকট্রন সংখ্যা তার পারমাণবিক সংখ্যার সমান।
IUPAC এর পূর্ণরূপ কী?
IUPAC= International Union of Pure and Applied Chemistry (আন্তর্জাতিক রসায়ন ও ফলিত রসায়ন সংস্থা )
IUPAC সংস্থাটির এর কাজ কী?
IUPAC সংস্থাটি আন্তর্জাতিকভাবে রসায়ন ও ফলিত রসায়নের বিভিন্ন নিয়মকানুন, ক্রমবর্ধমান পরিবর্তনের কোনটি গ্রহণ করা যায় এবং কোনটি বর্জন করা উচিত এই বিষয়গুলাে দেখাশােনা এবং নিয়ন্ত্রণ করে।
আধুনিক পর্যায় সারণির দেখতে কেমন ?
আধুনিক পর্যায় সারণির বর্গাকার।
আধুনিক পর্যায় সারণির বৈশিষ্ট্যসমূহ উল্লেখ করো ।
আধুনিক পর্যায় সারণির অনেক বৈশিষ্ট্য রয়েছে।
(a) পর্যায় সারণিতে 7 টি পর্যায় (Period) বা আনুভূমিক সারি এবং 18টি গ্রুপ বা খাড়া স্তম্ভ রয়েছে।
(b) প্রতিটি পর্যায় বাম দিকে গ্রুপ 1 থেকে শুরু করে ডানদিকে গ্রুপ 18 পর্যন্ত বিস্তৃত।
(c) মূল পর্যায় সারণির নিচে আলাদাভাবে ল্যান্থানাইড ও অ্যাকটিনাইড সারির মৌল হিসেবে দেখানাে হলেও এগুলাে যথাক্রমে 6 এবং 7 পর্যায়ের অংশ।
(d)
(i) পর্যায় 1 এ শুধু 2টি মৌল রয়েছে।
(ii) পর্যায় 2 এবং পর্যায় 3 এ ৪টি করে মৌল রয়েছে।
(iii) পর্যায় 4 এবং পর্যায় 5 এ 18টি করে মৌল রয়েছে।
(iv) পর্যায় 6 এবং পর্যায় 7 এ 32টি করে মৌল রয়েছে।
(e)
(i) গ্রুপ 1 এ 7 টি মৌল রয়েছে।
(ii) গ্রুপ 2 এ 6 টি মৌল রয়েছে।
(iii) গ্রুপ 3 এ 32টি মৌল রয়েছে।
(iv) গ্রুপ 4 থেকে গ্রুপ 12 পর্যন্ত প্রত্যেকটি গ্রুপে 4টি করে মৌল রয়েছে।
(v) গ্রুপ 13 থেকে গ্রুপ 17 পর্যন্ত প্রত্যেকটিতে 6টি করে মৌল রয়েছে।
(vi) গ্রুপ 18 এ 7টি মৌল রয়েছে।
যে সকল মৌলের পারমাণবিক সংখ্যা 57 থেকে 71 পর্যন্ত এরকম 15টি মৌলকে ল্যান্থানাইড সারির মৌল বলা হয়। যে সকল মৌলের পারমাণবিক সংখ্যা ৪9 থেকে 103 পর্যন্ত এরকম 15টি মৌলকে অ্যাকটিনাইড সারির মৌল বলা হয়। ল্যান্থানাইড সারির মৌলগুলাের ধর্ম এত কাছাকাছি এবং অ্যাকটিনাইড সারির মৌলসমূহের ধর্ম এত কাছাকাছি যে তাদেরকে পর্যায় সারণির নিচে ল্যান্থানাইড সারির মৌল এবং অ্যাকটিনাইড সারির মৌল হিসেবে আলাদাভাবে রাখা হয়েছে।
যদি মৌলগুলাের ধর্মের ভিত্তিতে বিবেচনা করা হয় তাহলে নিচের বৈশিষ্ট্যগুলাে লক্ষ করা যায়:
- একই পর্যায়ের বাম থেকে ডানের দিকে গেলে মৌলসমূহের ধর্ম ক্রমান্বয়ে পরিবর্তিত হয়।
- একই গ্রুপের মৌলগুলাের ভৌত এবং রাসায়নিক ধর্ম প্রায় একই রকমের হয়।
ইলেকট্রন বিন্যাস থেকে কীভাবে পর্যায় সারণিতে মৌলের অবস্থান নির্ণয়:
আমরা কোনাে একটি মৌলের ইলেকট্রন বিন্যাস থেকে সহজেই মৌলটি কোন গ্রুপ( কত নম্বর )এবং কোন পর্যায়ে ( কত নম্বর ) রয়েছে সেটি বের করতে পারি। নিচে পর্যায় সারণিতে কোনাে মৌলের অবস্থান নির্ণয়ের পদ্ধতি বর্ণনা করা হলো।
পর্যায় নম্বর বের করার নিয়ম:
কোনাে মৌলের ইলেকট্রন বিন্যাসের সবচেয়ে বাইরের প্রধান শক্তিস্তরের নম্বরই ঐ মৌলের পর্যায় নম্বর। যেমন- Li এর ইলেকট্রন বিন্যাস হলাে: Li(3) → 1s22s1। যেহেতু লিথিয়ামের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের শক্তিস্তর 2, তাই লিথিয়াম 2 নম্বর পর্যায়ের মৌল।
K এর ইলেকট্রন বিন্যাস হলাে: K(19) → 1s22s22p63s23p64s1 যেহেতু পটাশিয়ামের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তর 4, তাই পটাশিয়াম 4 নম্বর পর্যায়ের মৌল।
গ্রুপ নম্বর বের করার নিয়ম:
কোনাে মৌলের গ্রুপ নম্বর বের করার কয়েকটি নিয়ম আছে।
নিয়ম 1: কোনাে মৌলের ইলেকট্রন বিন্যাসের বাইরের প্রধান শক্তিস্তরে যদি শুধু s অরবিটাল থাকে তবে ঐ s অরবিটাল এর মােট ইলেকট্রন সংখ্যাই ঐ মৌলের গ্রুপ নম্বর। যেমন; হাইড্রোজেন, H(1) মৌলের ইলেকট্রন বিন্যাস 1s1। এখানে s অরবিটালে 1টি ইলেকট্রন আছে। কাজেই হাইড্রোজেন-এর গ্রুপ বা শ্রেণি নম্বর 1
নিয়ম 2: কোনাে মৌলের ইলেকট্রন বিন্যাসের বাইরের প্রধান শক্তিস্তর যদি শুধু s ও p অরবিটাল থাকে তবে ঐ s ও p অরবিটাল-এর মােট ইলেকট্রন সংখ্যার সাথে 10 যােগ করলে যে সংখ্যা পাওয়া যায় সেই সংখ্যাই ঐ মৌলের গ্রুপ নম্বর। যেমন: বােরন B(5) মৌলের ইলেকট্রন বিন্যাস 1s2 2s2 2p1। এখানে বােরনের বাইরের শেলে s অরবিটালে 2টি ইলেকট্রন ও p অরবিটালে 1 টি ইলেকট্রন আছে। কাজেই বােরন এর গ্রুপ নম্বর 2 + 1 + 10 = 13
শুধু ২য় ও ৩য় পর্যায়ের ক্ষেত্রে এই নিয়মটি প্রযোজ্য হয় ।
নিয়ম 3: কোনাে মৌলের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তরে যদি s অরবিটাল থাকে এবং আগের প্রধান শক্তিস্তরে যদি d অরবিটাল থাকে তবে s অরবিটাল ও d অরবিটালের ইলেকট্রন সংখ্যা যােগ করলেই গ্রুপ নম্বর পাওয়া যায়। যেমন: Fe(26) মৌলের ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 3p6 3d6 4s2 এখানে আয়রন এর বাইরের শক্তিস্তরে s অরবিটাল আছে এবং তার আগের শক্তিস্তরে d অরবিটাল আছে। এখানে d অরবিটালে 6টি এবং s অরবিটালে 2টি ইলেকট্রন আছে। কাজেই আয়রন-এর গ্রুপ নম্বর 6 + 2 =8।
নিয়ম 4 :কোনাে মৌলের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তরে অষ্টক(8 টি ইলেকট্রন) পূর্ণ হলে অবশ্য 18 নং গ্রুপ হয়। শুধু He এর ক্ষেত্রে দ্বিত্ব পূর্ণ থাকে।
ইলেকট্রন বিন্যাসই পর্যায় সারণির মূল ভিত্তি ব্যাখ্যা করো । পর্যায় সারণির মূল ভিত্তি কী? (Electronic Configurations of Elements are the Main Basis of the Periodic Table)
ইলেকট্রন বিন্যাসই আধুনিক পর্যায় সারণির মূল ভিত্তি । যখন পর্যায় সারণি সৃষ্টি করা হয় তখন পারমাণবিক ভরকে পর্যায় সারণির মূল ভিত্তি হিসাবে ধরা হয়েছিল । এতে পর্যায় সারণির কিছু ত্রুটি পরিলক্ষিত হয়। পরবর্তীতে পারমাণবিক সংখ্যা আবিস্কারের পর পারমাণবিক সংখ্যাকে পর্যায় সারণির মূল ভিত্তি ধরা হয় । বর্তমানে আধুনিক পর্যায় সারণির মূল ভিত্তি হলো ইলেকট্রন বিন্যাস । কারণ
ইলেকট্রন বিন্যাসের মাধ্যমে কোনাে মৌল কত নম্বর পর্যায় এবং কত নম্বর গুপে অবস্থান করে তা সহজে বের করা যায়। আবার মৌলসমূহের অনেক ধর্ম ও ব্যাখ্যা করা যায় । যেমন :
পর্যায় নম্বর বের করার নিয়ম:
কোনাে মৌলের ইলেকট্রন বিন্যাসের সবচেয়ে বাইরের প্রধান শক্তিস্তরের নম্বরই ঐ মৌলের পর্যায় নম্বর। যেমন- Li এর ইলেকট্রন বিন্যাস হলাে: Li(3) → 1s22s1। যেহেতু লিথিয়ামের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের শক্তিস্তর 2, তাই লিথিয়াম 2 নম্বর পর্যায়ের মৌল।
K এর ইলেকট্রন বিন্যাস হলাে: K(19) → 1s22s22p63s23p64s1 যেহেতু পটাশিয়ামের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তর 4, তাই পটাশিয়াম 4 নম্বর পর্যায়ের মৌল।
গ্রুপ নম্বর বের করার নিয়ম:
কোনাে মৌলের গ্রুপ নম্বর বের করার কয়েকটি নিয়ম আছে।
নিয়ম 1: কোনাে মৌলের ইলেকট্রন বিন্যাসের বাইরের প্রধান শক্তিস্তরে যদি শুধু s অরবিটাল থাকে তবে ঐ s অরবিটাল এর মােট ইলেকট্রন সংখ্যাই ঐ মৌলের গ্রুপ নম্বর। যেমন; হাইড্রোজেন, H(1) মৌলের ইলেকট্রন বিন্যাস 1s1। এখানে s অরবিটালে 1টি ইলেকট্রন আছে। কাজেই হাইড্রোজেন-এর গ্রুপ বা শ্রেণি নম্বর 1
নিয়ম 2: কোনাে মৌলের ইলেকট্রন বিন্যাসের বাইরের প্রধান শক্তিস্তর যদি শুধু s ও p অরবিটাল থাকে তবে ঐ s ও p অরবিটাল-এর মােট ইলেকট্রন সংখ্যার সাথে 10 যােগ করলে যে সংখ্যা পাওয়া যায় সেই সংখ্যাই ঐ মৌলের গ্রুপ নম্বর। যেমন: বােরন B(5) মৌলের ইলেকট্রন বিন্যাস 1s2 2s2 2p1। এখানে বােরনের বাইরের শেলে s অরবিটালে 2টি ইলেকট্রন ও p অরবিটালে 1 টি ইলেকট্রন আছে। কাজেই বােরন এর গ্রুপ নম্বর 2 + 1 + 10 = 13
শুধু ২য় ও ৩য় পর্যায়ের ক্ষেত্রে এই নিয়মটি প্রযোজ্য হয় ।
নিয়ম 3: কোনাে মৌলের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তরে যদি s অরবিটাল থাকে এবং আগের প্রধান শক্তিস্তরে যদি d অরবিটাল থাকে তবে s অরবিটাল ও d অরবিটালের ইলেকট্রন সংখ্যা যােগ করলেই গ্রুপ নম্বর পাওয়া যায়। যেমন: Fe(26) মৌলের ইলেকট্রন বিন্যাস 1s2 2s2 2p6 3s2 3p6 3d6 4s2 এখানে আয়রন এর বাইরের শক্তিস্তরে s অরবিটাল আছে এবং তার আগের শক্তিস্তরে d অরবিটাল আছে। এখানে d অরবিটালে 6টি এবং s অরবিটালে 2টি ইলেকট্রন আছে। কাজেই আয়রন-এর গ্রুপ নম্বর 6 + 2 =8।
নিয়ম 4 :কোনাে মৌলের ইলেকট্রন বিন্যাসে সবচেয়ে বাইরের প্রধান শক্তিস্তরে অষ্টক(8 টি ইলেকট্রন) পূর্ণ হলে অবশ্য 18 নং গ্রুপ হয়। শুধু He এর ক্ষেত্রে দ্বিত্ব পূর্ণ থাকে।
আবার, যে সকল মৌলের বাইরের প্রধান শক্তিস্তরের ইলেকট্রন বিন্যাস একই রকম সে সকল মৌল একই গ্রুপে অবস্থান করে।
অপরদিকে যে সকল মৌলের বাইরের প্রধান শক্তিস্তরের ইলেকট্রন বিন্যাস ভিন্ন রকম সে সকল মৌল ভিন্ন গ্রুপে অবস্থান করে।
যে সকল মৌলের ইলেকট্রন বিন্যাসে বাইরের শক্তিস্তরে মােট ইলেকট্রন সংখ্যা 1 টি সে সকল মৌল সাধারণত ইলেকট্রন দান করে ধনাত্মক আয়নে পরিণত হওয়ার প্রবণতা দেখায়। যেমন- সােডিয়ামের বাইরের শেলে এটি ইলেকট্রন আছে। তাই সােডিয়াম ঐ 1 টি ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হয়।
Na (1s22s22p63s1) → Na+ (1s22s22p6) + e–
আবার যে সকল মৌলের ইলেকট্রন বিন্যাসে বাইরের শক্তিস্তরে মােট ইলেকট্রন সংখ্যা 7 টি সে সকল মৌল সাধারণত এটি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হবার প্রবণতা দেখায়। যেমন-ক্লোরিনের বাইরের শেলে ৭টি ইলেকট্রন আছে। তাই ক্লোরিন 1টি ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয়।
Cl (1s22s22p63s23p5) + e– → Cl– (1s22s22p63s23p6)
অতএব ইলেকট্রন বিন্যাসের মাধ্যমে পর্যায় সারণিতে মৌলের অবস্থান নির্ণয় ও মৌলসমূহের অনেক ধর্ম ব্যাখ্যা করা যায়।
এ সকল তথ্য হতে নিঃসন্দেহে বলা যায় যে, পর্যায় সারণির মূল ভিত্তি হচ্ছে মৌলসমূহের ইলেকট্রন বিন্যাস।
পর্যায় সারণির কিছু ব্যতিক্রম/পর্যায় সারণির ব্যতিক্রম বিষয়গুলো আলোচনা করো।
(a) হাইড্রোজেনের অবস্থান: হাইড্রোজেন একটি অধাতু। কিন্তু পর্যায় সারণিতে হাইড্রোজেনকে তীব্র তড়িৎ ধনাত্মক ক্ষার ধাতু Na, K, Rb, Cs, Fr এর সাথে গ্রুপ-1 এ স্থান দেওয়া হয়েছে। এর কারণ ক্ষার ধাতুর মতাে H এর বাইরের প্রধান শক্তিস্তরে একটিমাত্র ইলেকট্রন রয়েছে। আবার, হাইড্রোজেনের অনেক ধর্ম ক্ষার ধাতুগুলাের ধর্মের সাথে মিলে যায়।
হাইড্রোজেনকে গ্রুপ 1 এ ক্ষার ধাতুর সঙ্গে স্থান দেওয়ার পক্ষে যুক্তিসমূহ নিম্নরূপঃ
১। যােজ্যতা ইলেকট্রন: ক্ষার ধাতুসমূহ যেমন; Li, Na, K, Rb প্রভৃতির ন্যায় হাইড্রোজেনেরও একটিমাত্র যােজ্যতা ইলেকট্রন আছে। যেমন,
Li (3) = 1s2 2s1 Na (11) = 1s2 2s2 2p6 3s1 H (1) = 1s1
২। তড়িৎ ধনাত্মকতা: ক্ষার ধাতুর ন্যায় H মৌলটি তড়িৎ-ধনাত্মক; ফলে এটি সহজেই ইলেকট্রন ত্যাগ করে ধনাত্মক হাইড্রোজেন আয়ন বা প্রােটন (H+)-এ পরিণত হয়। যেমন,
Na → Na+ + e– , H → H+ + e–
৩। ধাতুর মত হ্যালাইড গঠন: ক্ষার ধাতুর ন্যায় হাইড্রোজেনও ঋণাত্মক হ্যালােজেনের সাথে যুক্ত হয়ে হ্যালাইড ও অক্সিজেনের সাথে যুক্ত হয়ে অক্সাইড
গঠন করে। যেমন, 2Na + Cl2 =2NaCl, H2+ Cl2= 2HCl
4Na + O2 =2Na2O, 2H2+O2= 2H2O
৪। ক্যাথােডে বিজারণ: ক্ষার ধাতুর হ্যালাইডের গলিত তরলকে যেমন গলিত NaCI-কে তড়িৎ-বিশ্লেষণ করলে সংশ্লিষ্ট ধাতু যেমন Na ধাতু ক্যাথােডে জমা হয়; তেমনি হাইড্রোজেন হ্যালাইড যেমন HCl-এর দ্রবণকে তড়িৎ বিশ্লেষণ করলেও H2 ক্যাথােডে জমা হয়।
৫। বিজারণ ধর্ম: ক্ষার ধাতু বা যে কোন ধাতুর মত হাইড্রোজেনও একটি শক্তিশালী বিজারক।
Na ধাতু দ্বারা Cl2 এর বিজারণ: Cl2(g) + 2Na(s) →2NaCl(s)
H2 দ্বারা Cl2 এর বিজারণ: Cl2(g) +H2(g) → 2HCl(g)
অন্যদিকে, হ্যালােজেন মৌল (F, Cl, Br, I) এর একটি পরমাণু যেমন একটি ইলেকট্রন গ্রহণ করতে পারে, হাইড্রোজেনও তেমনি একটি ইলেকট্রন গ্রহণ করতে পারে অর্থাৎ H এর অনেক ধর্ম হ্যালােজেন মৌলের ধর্মের সাথেও মিলে যায়।
হাইড্রোজেনকে গ্রুপ 17 তে হ্যালােজেনের সঙ্গে স্থান দেওয়ার পক্ষে যুক্তিসমূহ নিম্নরূপঃ
১। অধাতু : হ্যালােজেনসমূহ যেমন ফ্লোরিন, ক্লোরিন, ব্রোমিন ও আয়ােডিনের ন্যায় হাইড্রোজেনও একটি অধাতু।
২। পরমাণুকত্ব: হ্যালােজেনসমূহের মত হাইড্রোজেনও দ্বি-পরমাণুক। যেমন, Cl2, Br2, H2
৩। ইলেকট্রন বিন্যাসঃ প্রত্যেক হ্যালােজেন সদস্যের পরমাণুর ন্যায় হাইড্রোজেন পরমাণুর সর্ববহিস্থ শক্তিস্তরে এর নিকটস্থ নিষ্ক্রিয় গ্যাস হিলিয়াম পরমাণুর চেয়ে একটি ইলেকট্রন কম। যেমন:1H=1s1 , 9F=1s22s22p5
৪। ধাতব হাইড্রাইড গঠন: হ্যালােজেন যেমন ধাতুর সঙ্গে যুক্ত হয়ে ধাতব হ্যালাইড (যেমন NaCl) গঠন করে; তেমনি হাইড্রোজেনও ঋণাত্মক হাইড্রাইড আয়ন (H–) উৎপন্ন করে ধাতব হাইড্রাইড (যেমন NaH) সৃষ্টি করে।
৫। প্রােটন সংখ্যার ক্রম: হাইড্রোজেনের প্রােটন সংখ্যা 1 এবং হিলিয়ামের প্রােটন সংখ্যা হল 2 ; সুতরাং . হিলিয়ামের ঠিক পূর্বেই অর্থাৎ গ্রুপ 17 তে ফ্লোরিনের উপরে H-এর স্থান হওয়া উচিত।
৬) যােজনী: হ্যালােজেনসমূহের মত হাইড্রোজেনও একযােজী। যেমন, HCl
তবে হাইড্রোজেনের বেশির ভাগ ধর্ম ক্ষার ধাতুসমূহের ধর্মের সাথে মিলে যাওয়ায় একে ক্ষার ধাতুর সাথে গ্রুপ 1 এ স্থান দেওয়া হয়েছে।
( পর্যায় সারণিতে হাইড্রোজেনের অবস্থান নিয়ে এখনাে বিতর্ক রয়েছে। প্রথমদিকে এ মৌলকে গ্রুপ 1 এর সদস্য হিসেবে বিবেচনা করা হত। কিন্তু একই সাথে গ্রুপ 17 মৌলসমূহের সাথে অনেক ধর্মের সামঞ্জস্যর কারণে সেখানে রাখার পক্ষেও যুক্তি দেখানাে হয়। বর্তমানে অধিকাংশ বিজ্ঞানী এ মৌলকে উভয় স্থানে রাখার পক্ষপাতী।)
(b) হিলিয়ামের অবস্থান: হিলিয়ামের ইলেকট্রন বিন্যাস He(2)→ 1s2। হিলিয়ামের ইলেকট্রন বিন্যাস অনুসারে একে গ্রুপ-2 এ স্থান দেওয়া উচিত ছিল। কিন্তু গ্রুপ-2 এর মৌলসমূহ তীব্র তড়িৎ ধনাত্মক। এদের মৃৎক্ষার ধাতু বলে। অপরদিকে He একটি নিষ্ক্রিয় গ্যাস।এর ধর্ম অন্যান্য নিষ্ক্রিয় গ্যাস নিয়ন, আর্গন, ক্রিপ্টন, জেনন, রেডন ইত্যাদির সাথে মিলে যায়। He এর ধর্ম কখনই তীব্র তড়িৎ ধনাত্মক মৃৎক্ষার ধাতুর মতাে হয় না। তাই হিলিয়ামকে নিষ্ক্রিয় গ্যাসসমূহের সাথে গ্রুপ-18 তে স্থান দেওয়া হয়েছে।
(c) ল্যান্থানাইড সারির এবং অ্যাকটিনাইড সারির মৌলগুলোর অবস্থান: পর্যায় সারণিতে ল্যান্থানাইড সারির মৌলগুলাে 6 নম্বর পর্যায় ও 3 নম্বর গ্রুপে অবস্থিত এবং অ্যাকটিনাইড সারির মৌলগুলাে 7 নম্বর পর্যায় ও 3 নম্বর গ্রুপে অবস্থিত। এই অবস্থানগুলােতে ল্যান্থানাইড সারির এবং অ্যাকটিনাইড সারির মৌলগুলােকে বসালে পর্যায় সারণির সৌন্দর্য নষ্ট হয়। কাজেই পর্যায় সারণিকে সুন্দরভাবে দেখানাের জন্য ল্যান্থানাইড সারির এবং অ্যাকটিনাইড সারির মৌলগুলােকে পর্যায় সারণির নিচে আলাদাভাবে রাখা হয়েছে। তাছাড়া পর্যায় সারণিতে একটি ঘরে একটি মাত্র মৌলই অবস্থান করে ।
মৌলের পর্যায়বৃত্ত ধর্ম (Periodic Properties of Elements):
পর্যায় সারণিতে অবস্থিত মৌলগুলাের কিছু ধর্ম আছে যেমন: ধাতব ধর্ম, অধাতব ধর্ম,জারণ সংখ্যা, গলনাঙ্ক ও স্ফুটনাঙ্ক ,যোজনী, পরমাণুর আকার, আয়নিকরণ শক্তি, তড়িৎ ঋণাত্মকতা, ইলেকট্রন আসক্তি ইত্যাদি। এসব ধর্মকে পর্যায়বৃত্ত ধর্ম বলে।
পর্যায়বৃত্ত ধর্ম (Periodic properties): কাকে বলে ?
পর্যায় সারণীর একই পর্যায় বা একই গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে উহাদের যে সব ধর্ম ক্রমান্বয়ে পরিবর্তিত হয়, তাদেরকে পর্যায়বৃত্তিক ধর্ম বলা হয়। যেমন- মৌলের পারমাণবিক আকার, আয়নিকরণ শক্তি, তড়িৎ ঋণাত্মকতা, ইলেকট্রন আসক্তি ইত্যাদি।
ধাতু কাকে বলে?
যে সকল মৌল চকচকে, আঘাত করলে ধাতব শব্দ করে এবং তাপ ও বিদ্যুৎ পরিবাহী তাদেরকে ধাতু বলে।
আধুনিক সংজ্ঞা অনুযায়ী যে সকল মৌল এক বা একাধিক ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হয় তাদেরকে ধাতু বলে। যেমন- লিথিয়াম (Li) একটি ধাতু কারণ Li একটি ইলেকট্রন ত্যাগ করে Li+ এ পরিণত হয়। Li → Li+ + e-
ধাতব ধর্ম কাকে বলে?
ধাতুসমূহ এক বা একাধিক ইলেকট্রন ত্যাগ করে ধনাত্মক আয়নে পরিণত হয়। ধাতুসমূহের ইলেকট্রন ত্যাগের এই ধর্মকে ধাতব ধর্ম বলে।
কোন ধরণের মৌলের ধাতব ধর্ম বেশি?
যে সকল মৌলের পরমাণু যত সহজে ইলেকট্রন ত্যাগ করতে পারবে সেই সকল মৌলের ধাতব ধর্ম তত বেশি।
পর্যায় সারণিতে ধাতব ধর্ম কীভাবে পরিবর্তিত হয়?
পর্যায় সারণিতে যেকোনাে পর্যায়ের বাম থেকে ডানে গেলে ধাতব ধর্ম হ্রাস পায়। আবার যেকোনাে গ্রুপের উপর থেকে নিচে গেলে ধাতব ধর্ম বৃদ্ধি পায়।
অধাতু কাকে বলে?
যে সকল মৌল চকচকে নয়, আঘাত করলে ধাতব শব্দ করে না এবং তাপ ও বিদ্যুৎ পরিবাহী নয় তাদেরকে অধাতু বলে।
আধুনিক সংজ্ঞা অনুযায়ী যেসকল মৌল এক বা একাধিক ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয় তাদেরকে অধাতু বলে।যেমন: ক্লোরিন (Cl) একটি অধাতু কারণ Cl একটি ইলেকট্রন গ্রহণ করে Cl এ পরিণত হয়। Cl + e– → Cl–
অধাতব ধর্ম কাকে বলে?
অধাতুসমূহ এক বা একাধিক ইলেকট্রন গ্রহণ করে ঋণাত্মক আয়নে পরিণত হয়। অধাতুর ইলেকট্রন গ্রহণের এই ধর্মকে অধাতব ধর্ম বলে।
কোন ধরণের মৌলের অধাতব ধর্ম বেশি?
যে মৌলের পরমাণু যত সহজে ইলেকট্রন গ্রহণ করতে পারবে সেই মৌলের অধাতব ধর্ম তত বেশি।
পর্যায় সারণিতে অধাতব ধর্ম কীভাবে পরিবর্তিত হয়?
পর্যায় সারণিতে যেকোনাে পর্যায়ের বাম থেকে ডানে গেলে অধাতব ধর্ম বৃদ্ধি পায়। আবার যেকোনাে গ্রুপের উপর থেকে নিচে গেলে অধাতব ধর্ম হ্রাস পায়।
অর্ধধাতু বা অপধাতু কাকে বলে?
যে সকল মৌল কোনাে কোনাে সময় ধাতুর মতাে আচরণ করে এবং কোনাে কোনাে সময় অধাতুর মতাে আচরণ করে তাদেরকে অর্ধধাতু বা অপধাতু বলা হয়। আবার আধুনিক সংজ্ঞা অনুযায়ী যে সকল মৌল কোনাে কোনাে সময় ইলেকট্রন ত্যাগ করে এবং কোনাে কোনাে সময় ইলেকট্রন গ্রহণ করে তাদেরকে অপধাতু বলে। যেমন: সিলিকন (Si) একটি অপধাতু।
সাধারণত পর্যায় সারণির মৌলগুলাের ধর্ম কীভাবে পরিবর্তিত হয় ?
পর্যায় সারণির যেকোনাে একটি পর্যায়ের দিকে লক্ষ করলে দেখা যাবে যে, বাম দিকের মৌলগুলাে সাধারণত ধাতু, মাঝের মৌলগুলাে সাধারণত অর্ধধাতু বা উপধাতু এবং ডান দিকের মৌলগুলাে সাধারণত অধাতু।
পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ (Size of Atom/Atomic Radius) কাকে বলে ?
পারমাণবিক ব্যাসার্ধ : সাধারণভাবে কোন পরমাণুর নিউক্লিয়াসের কেন্দ্র ও এর সর্ববহিস্থ ইলেকট্রন স্তরের মধ্যবর্তী দূরত্বকে পারমাণবিক ব্যাসার্ধ বলে।
পরমাণুর আকার তথা পারমাণবিক ব্যাসার্ধ একটি পর্যায়বৃত্ত ধর্ম-ব্যাখ্যা করো।
আমরা জানি, পর্যায় সারণীর একই পর্যায় বা একই গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে তাদের যে সব ধর্ম ক্রমান্বয়ে বা পর্যায়ক্রমে আবর্তিত বা পরিবর্তিত হয়, তাদেরকে পর্যায়বৃত্তিক ধর্ম বলা হয়। পরমাণুর আকার তথা পারমাণবিক ব্যাসার্ধ একটি পর্যায়বৃত্ত ধর্ম। কারণ যেকোনাে একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত কমতে থাকে এবং যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত বাড়তে থাকে।
একই পর্যায়ের বাম দিক থেকে যত ডান দিকে যাওয়া যায় পারমাণবিক সংখ্যা তত বাড়তে থাকে কিন্তু প্রধান শক্তিস্তরের সংখ্যা বাড়ে না। পারমাণবিক সংখ্যা বাড়লে নিউক্লিয়াসে প্রােটন সংখ্যা বৃদ্ধি পায় এবং ইলেকট্রন সংখ্যাও বৃদ্ধি পায়। নিউক্লিয়াসের অধিক প্রােটন সংখ্যা এবং নিউক্লিয়াসের বাইরের অধিক ইলেকট্রন সংখ্যার মধ্যে আকর্ষণ বেশি হয় ফলে ইলেকট্রনগুলাের শক্তিস্তর নিউক্লিয়াসের কাছে চলে আসে, ফলে পরমাণুর আকার ছােট হয়ে যায়। যেমন- তৃতীয় পর্যায়ের মৌলগুলোকে পারমাণবিক আকার অনুসারে সাজালে নিম্নলিখিত ক্রম পাওয়া যায়। Na> Mg> Al> Si> P> S> Cl
তৃতীয় পর্যায়ের মৌলগুলোর ইলেক্ট্রন বিন্যাস ও পারমাণবিক ব্যাসার্ধ: [1 pm=10-12 m]
| মৌল | Na | Mg | Al | Si | P | S | Cl |
| ইলেক্ট্রন বিন্যাস | 2,8,1 | 2,8,2 | 2,8,3 | 2,8,4 | 2,8,5 | 2,8,6 | 2,8,7 |
| পারমাণবিক ব্যাসার্ধ:(pm) | 157 | 136 | 125 | 117 | 110 | 104 | 99 |
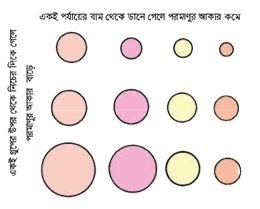
চিত্র: পরমাণুর আকারের পর্যায়বৃত্ত ধর্ম।
আবার, একই গ্রুপে যতই উপর থেকে নিচের দিকে যাওয়া যায় ততই বাইরের দিকে একটি করে নতুন শক্তিস্তর যুক্ত হয়। একটি করে নতুন শক্তিস্তর যুক্ত হলে পরমাণুর আকার বৃদ্ধি পায়।
একই গ্রুপের উপর থেকে নিচের দিকে গেলে নিউক্লিয়াসের প্রােটন সংখ্যা এবং বাইরের কক্ষপথের ইলেকট্রন সংখ্যা বৃদ্ধির জন্য আকর্ষণ বৃদ্ধি হয়ে পরমাণুর আকার যতটুকু হ্রাস পায়, নতুন একটি শক্তিস্তর যােগ হওয়ার কারণে পরমাণুর আকার তার চেয়ে বেশি বৃদ্ধি পায়। যে কারণে উপরের মৌলের চেয়ে নিচের মৌলের আকার বড় হয়।যেমন- 1 গ্রুপের মৌলগুলোকে পারমাণবিক আকার অনুসারে সাজালে নিম্নলিখিত ক্রম পাওয়া যায়। Li < Na < K<Rb<Fr
1 গ্রুপের মৌলগুলোর ইলেক্ট্রন বিন্যাস ও পারমাণবিক ব্যাসার্ধ: [1 pm=10-12 m]
| মৌল | ইলেক্ট্রন বিন্যাস | পারমাণবিক ব্যাসার্ধ:(pm) |
| Li | 2,1 | 123 |
| Na | 2,8,1 | 157 |
| K | 2,8,8,1 | 203 |
| Rb | 2,8,18,8,1 | 216 |
| Cs | 2,8,18,18,8,1 | 235 |
সুতরাং , উপরিউক্ত আলোচনা থেকে বলা যায় যে, পরমাণুর আকার তথা পারমাণবিক ব্যাসার্ধ একটি পর্যায়বৃত্ত ধর্ম।
একই পর্যায়ের বাম থেকে ডান দিকে গেলে পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ কীভাবে পরিবর্তিত হয় ?
একই গ্রুপের উপর থেকে নিচে গেলে পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ কীভাবে পরিবর্তিত হয় ?
একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত কমতে থাকে এবং যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত বাড়তে থাকে কেন তা ব্যাখ্যা করো ।
ব্যতিক্রম :
যেকোনাে একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় পরমাণুর আকার/পারমাণবিক ব্যাসার্ধ তত কমতে থাকে কিন্তু হ্যালোজেনের ক্ষেত্রে সংশ্লিষ্ট পর্যায়ের নিষ্ক্রিয় গ্যাসের পারমাণবিক ব্যাসার্ধের মান বেশি হয়। যেমন-দ্বিতীয় পর্যায়ে ফ্লোরিন F(9) এর পরবর্তী নিষ্ক্রিয় মৌল নিয়ন Ne(10) হওয়ায়, Ne পরমাণুর ব্যাসার্ধ F পরমাণু অপেক্ষা কম হওয়া উচিত । কিন্তু বাস্তবে তা না হয়ে তার বিপরীত হয় । এর কারণ ফ্লোরিন দ্বিপরমাণুক। যেহেতু ফ্লোরিন দ্বিপরমাণুক অণু গঠন করে তাই ফ্লোরিনের পারমাণবিক ব্যাসার্ধের পরিমাপ হলাে- অণুতে উপস্থিত নিউক্লিয়াস দুটির মধ্যবর্তী দূরত্বের অর্ধেকের সমান (বা F, অণুর সমযােজী বন্ধন দৈর্ঘ্যের অর্ধেকের সমান)। কিন্তু Ne একটি নিষ্ক্রিয় গ্যাস হওয়ায় তার পরমাণুগুলাে পরস্পরের সাথে সমযােজী বন্ধন দ্বারা যুক্ত হতে পারে না। পরমাণুগুলাের মধ্যে, কেবল দুর্বল ভ্যানডার ওয়ালস্ আকর্ষণ বল কাজ করে। তাই নিয়নের পারমাণবিক ব্যাসার্ধের পরিমাপ হলাে তার ভ্যানডার ওয়ালস ব্যাসার্ধের সমান। কিন্তু ভ্যানডার ওয়ালস ব্যাসার্ধের মান, সমযােজী বন্ধন দৈর্ঘ্যের অর্ধেক অপেক্ষা সর্বদা বেশি হয় বলে, ফ্লোরিন অপেক্ষা নিয়নের পারমাণবিক ব্যাসার্ধের মান বেশি হয়।
আয়নিকরণ শক্তি (Ionization Energy) কাকে বলে ? আয়নিকরণ বিভব বা আয়নিকরণ পটেনশিয়াল বলতে কী বুঝো ?
গ্যাসীয় অবস্থায় কোনাে মৌলের এক মােল গ্যাসীয় পরমাণু থেকে এক মােল ইলেকট্রন অপসারণ করে এক মােল ধনাত্মক আয়নে পরিণত করতে যে শক্তির প্রয়ােজন হয়, তাকে ঐ মৌলের আয়নিকরণ শক্তি বলে।
মৌলের আয়নিকরণ শক্তি বা আয়নিকরণ বিভব বা আয়নিকরণ পটেনশিয়াল এর তালিকা
আয়নিকরণ শক্তি একটি পর্যায়বৃত্ত ধর্ম।-ব্যাখ্যা করো।
আমরা জানি, পর্যায় সারণীর একই পর্যায় বা একই গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে তাদের যে সব ধর্ম ক্রমান্বয়ে বা পর্যায়ক্রমে আবর্তিত বা পরিবর্তিত হয়, তাদেরকে পর্যায়বৃত্ত ধর্ম বলা হয়। আয়নিকরণ শক্তি একটি পর্যায়বৃত্ত ধর্ম। কারণ-একই পর্যায়ের বামের মৌলের পারমাণবিক ব্যাসার্ধ বেশি এবং ডানের মৌলের পারমাণবিক ব্যাসার্ধ কম। পারমাণবিক ব্যাসার্ধ কমলে আয়নিকরণ শক্তির মান বাড়ে এবং পারমাণবিক ব্যাসার্ধ বাড়লে আয়নিকরণ শক্তির মান কমে।
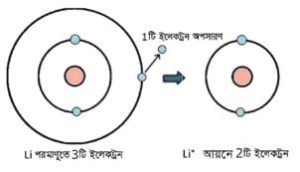
চিত্র: মৌলের আয়নিকরণ
যেমন: Na, Mg, Si, Al এর মধ্যে Si এর আয়নিকরণ শক্তির মান বেশি। কারণ এই মৌলগুলাের মধ্যে Si এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম। পক্ষান্তরে, এই মৌলগুলাের মধ্যে Na এর পারমাণবিক ব্যাসার্ধের মান বেশি বলে এদের মধ্যে সােডিয়াম এর আয়নিকরণ শক্তির মান কম।
গ্রুপ-1 এর Li, Na, K, Rb Cs, Fr ক্ষার ধাতুগুলাের মধ্যে Li এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম এজন্য এদের মধ্যে Li এর আয়নিকরণ শক্তির মান সবচেয়ে বেশি।
আবার, গ্রুপ-17 এর F, Cl, Br, I এবং At মৌলগুলাের মধ্যে F এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম, কাজেই এই মৌলগুলাের মধ্যে F এর আয়নিকরণ শক্তির মান সবচেয়ে বেশি।
একই পর্যায়ের বাম দিক থেকে যত ডান দিকে যাওয়া যায় পারমাণবিক সংখ্যা তত বাড়তে থাকে কিন্তু প্রধান শক্তিস্তরের সংখ্যা বাড়ে না। পারমাণবিক সংখ্যা বাড়লে নিউক্লিয়াসে প্রােটন সংখ্যা বৃদ্ধি পায় এবং ইলেকট্রন সংখ্যাও বৃদ্ধি পায়। নিউক্লিয়াসের অধিক প্রােটন সংখ্যা এবং নিউক্লিয়াসের বাইরের অধিক ইলেকট্রন সংখ্যার মধ্যে আকর্ষণ বেশি হয় ফলে ইলেকট্রনগুলাের শক্তিস্তর নিউক্লিয়াসের কাছে চলে আসে, তাই পরমাণুর আকার ছােট হয়ে যায়। নিউক্লিয়াসে চার্জ বৃদ্ধি এবং পরমাণুর আকার ছােট হওয়ায় বাইরের শক্তিস্তরের ইলেকক্ট্রন নিউক্লিয়াসের সাথে অধিকতর দৃঢ়ভাবে আবদ্ধ থাকে ফলে বাইরের শক্তিস্তরের ইলেক্ট্রন সহজে অপসারণ করা যায় না অর্থাৎ তা অপসারণের জন্য অধিক শক্তির প্রয়োজন হয় । তাই, আমরা বলতে পারি, একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় আয়নিকরণ শক্তির মান তত বাড়তে থাকে ( দুই – একটি ব্যতিক্রম ছাড়া)
আবার, একই গ্রুপে যতই উপর থেকে নিচের দিকে যাওয়া যায় ততই বাইরের দিকে একটি করে নতুন শক্তিস্তর যুক্ত হয়। একটি করে নতুন শক্তিস্তর যুক্ত হলে পরমাণুর আকার বৃদ্ধি পায়। একই গ্রুপের উপর থেকে নিচের দিকে গেলে নিউক্লিয়াসের প্রােটন সংখ্যা এবং বাইরের কক্ষপথের ইলেকট্রন সংখ্যা বৃদ্ধির জন্য আকর্ষণ বৃদ্ধি হয়ে পরমাণুর আকার যতটুকু হ্রাস পায়, নতুন একটি শক্তিস্তর যােগ হওয়ার কারণে পরমাণুর আকার তার চেয়ে বেশি বৃদ্ধি পায়। ফলে বাহিরের শক্তিস্তরের ইলেক্ট্রন নিক্লিয়াস থেকে ক্রমশ দূরে সরে যায় এবং এর উপর নিউক্লিয়াসের আকর্ষণ কমতে থাকে । তাই, বাইরের শক্তিস্তরের ইলেক্ট্রন সহজে অপসারণ করা যায় অর্থাৎ তা অপসারণের জন্য কম শক্তির প্রয়োজন হয় । সুতরাং আমরা বলতে পারি, যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় আয়নিকরণ শক্তির মান তত কমতে থাকে ।
অর্থাৎ উপরিউক্ত আলোচনা থেকে বলা যায় যে,আয়নিকরণ শক্তি একটি পর্যায়বৃত্ত ধর্ম।
একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় আয়নিকরণ শক্তির মান তত বাড়তে থাকে এবং যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় আয়নিকরণ শক্তির মান তত কমতে থাকে কেন তা ব্যাখ্যা করো ।
ব্যতিক্রম :
(১) বােরনের আয়নীকরণ শক্তি বেরিলিয়াম অপেক্ষা কম।
সাধারণত একই পর্যায়ে পারমানবিক সংখ্যা বৃদ্ধির সাথে আয়নীকরণ শক্তি বৃদ্ধি পায়। তবে পরমাণুর ইলেকট্রন বিন্যাসের উপর আয়নীকরণ শক্তি নির্ভর করে। বােরন ও বেরিলিয়ামের ইলেকট্রন বিন্যাস Be(4) = Is22s2 B(5) = Is22s22p1
আমরা জানি, সাধারণত পরমাণুর পরিপূর্ণ ও অর্ধপূর্ণ অরবিটালসমূহ অধিকতর স্থিতিশীল হয়ে থাকে। বােরনের ইলেকট্রন বিন্যাস B(5) =Is22s22p1। এক্ষেত্রে B এর ইলেকট্রন বিন্যাসে 2p অরবিটালটি পরিপূর্ণ নয় আবার অর্ধপূর্ণ নয় অর্থাৎ এটি স্থিতিশীল নয়। এর ফলে বােরন পরমাণুর বহিঃস্থ কক্ষপথ থেকে ইলেকট্রন অপসারণ করতে কম শক্তির প্রয়ােজন। আবার, Be পরমাণুর 2s অরবিটাল পূর্ণ অর্থাৎ এটি স্থিতিশীল । এই স্থায়িত্বের জন্য Be পরমাণুর বহিঃস্থ কক্ষপথ থেকে ইলেকট্রন অপসারণ করতে বেশি শক্তির প্রয়ােজন হয়। তাই একই পর্যায়ে বােরনের পারমাণবিক সংখ্যা বেরিলিয়াম অপেক্ষা বেশি সত্ত্বেও B-এর আয়নীকরণ শক্তি Be অপেক্ষা কম।
(২) অক্সিজেনের আয়নীকরণ শক্তি নাইট্রোজেন অপেক্ষা কম।
সাধারণত একই পর্যায়ে পারমানবিক সংখ্যা বৃদ্ধির সাথে আয়নীকরণ শক্তি বৃদ্ধি পায়। তবে পরমাণুর ইলেকট্রন বিন্যাসের উপর আয়নীকরণ শক্তি নির্ভর করে। আমরা জানি, সাধারণত পরমাণুর পরিপূর্ণ ও অর্ধপূর্ণ অরবিটালসমূহ অধিকতর স্থিতিশীল হয়ে থাকে। নাইট্রোজেন ও অক্সিজেনের ইলেকট্রন বিন্যাস 7N = 1s2 2s2 2p3 [2px1 2py1 2pz1] যা অর্ধপূর্ণ। ৪O = 1s2 2s2 2p4 [2px2 2py1 2pz1] যা পরিপূর্ণ নয় আবার অর্ধপূর্ণ নয় । নাইট্রোজেনের ইলেকট্রন বিন্যাস হতে দেখা যায় যে, এর p অরবিটালে একটি করে ইলেকট্রন বিদ্যমান অর্থাৎ অরবিটালগুলাে অর্ধপূর্ণ। ফলে ইলেকট্রন বিন্যাসটি স্থিতিশীল। তাই N পরমাণু থেকে একটি ইলেকট্রন অপসারণ করতে বেশি শক্তির দরকার। অন্যদিকে অক্সিজেনের ইলেকট্রন বিন্যাসে একটি p অরবিটালে দুটি এবং অন্য দুটিতে একটি করে ইলেকট্রন আছে। ফলে এ ইলেকট্রনিক কাঠামাে N-এর মত স্থিতিশীল নয়। তাই O থেকে একটি ইলেকট্রন অপসারণ করতে N-এর চেয়ে কম শক্তি লাগবে। অতএব বলা যায়, N এর আয়নীকরণ O অপেক্ষা বেশি ।
****মৌলের আয়নীকরণ শক্তি নিচের বিষয়ের উপর নির্ভরশীল। *****
(ii) নিউক্লিয়াসে চার্জ বৃদ্ধিতে আয়নীকরণ শক্তি বৃদ্ধি পায়—এটি হল পর্যায়ভিত্তিক সম্পর্ক।
(i) পরমাণুর আকার বৃদ্ধিতে আয়নীকরণ শক্তি হ্রাস পায়—এটি হল গ্রুপ ভিত্তিক সম্পর্ক।
(iii)অর্ধপূর্ণ ও পরিপূর্ণ অরবিটালযুক্ত পরমাণুর অধিক সুস্থিতির কারণে পর্যায়ভিত্তিক সম্পর্কে ব্যতিক্রম ঘটে।
ইলেকট্রন আসক্তি (Electron Affinities) কাকে বলে ?
গ্যাসীয় অবস্থায় কোনাে মৌলের এক মােল গ্যাসীয় পরমাণুতে এক মােল ইলেকট্রন প্রবেশ করিয়ে এক মােল ঋণাত্মক আয়নে পরিণত করতে যে শক্তি নির্গত হয়, তাকে ঐ মৌলের ইলেকট্রন আসক্তি বলে।
ইলেকট্রন আসক্তি একটি পর্যায়বৃত্ত ধর্ম। ব্যাখ্যা করো ।
আমরা জানি, পর্যায় সারণীর একই পর্যায় বা একই গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে তাদের যে সব ধর্ম ক্রমান্বয়ে বা পর্যায়ক্রমে আবর্তিত বা পরিবর্তিত হয়, তাদেরকে পর্যায়বৃত্ত ধর্ম বলা হয়। ইলেকট্রন আসক্তি একটি পর্যায়বৃত্ত ধর্ম। কারণ-একই পর্যায়ের বামের মৌলের পারমাণবিক ব্যাসার্ধ বেশি এবং ডানের মৌলের পারমাণবিক ব্যাসার্ধ কম। পারমাণবিক ব্যাসার্ধ কমলে ইলেকট্রন আসক্তির মান বাড়ে এবং পারমাণবিক ব্যাসার্ধ বাড়লে ইলেকট্রন আসক্তির মান কমে।
যেমন-Na, Mg, Al, Si এর মৌলগুলাে পর্যায় সারণির 3 নং পর্যায়ের মৌল। এই মৌলগুলাের মধ্যে Na এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে বেশি এজন্য সােডিয়াম এর ইলেকট্রন আসক্তির মান সবচেয়ে কম। আবার, Si এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম সেজন্য এর ইলেকট্রন আসক্তির মান সবচেয়ে বেশি।
আবার, Be, Ca, Sr, Ba, Mg এবং Ra মৌলগুলাে পর্যায় সারণির 2নং গ্রুপ-এর মৌল। এই মৌলগুলাের মধ্যে Be এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম, এর জন্য Be এর ইলেকট্রন আসক্তির মান সবচেয়ে বেশি। আবার Ra এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে বেশি, এর জন্য Ra ইলেকট্রন আসক্তি সবচেয়ে কম।
একই পর্যায়ের বাম দিক থেকে যত ডান দিকে যাওয়া যায় পারমাণবিক সংখ্যা তত বাড়তে থাকে কিন্তু প্রধান শক্তিস্তরের সংখ্যা বাড়ে না। পারমাণবিক সংখ্যা বাড়লে নিউক্লিয়াসে প্রােটন সংখ্যা বৃদ্ধি পায় এবং ইলেকট্রন সংখ্যাও বৃদ্ধি পায়। নিউক্লিয়াসের অধিক প্রােটন সংখ্যা এবং নিউক্লিয়াসের বাইরের অধিক ইলেকট্রন সংখ্যার মধ্যে আকর্ষণ বেশি হয় ফলে ইলেকট্রনগুলাের শক্তিস্তর নিউক্লিয়াসের কাছে চলে আসে, তাই পরমাণুর আকার ছােট হয়ে যায়। নিউক্লিয়াসে চার্জ বৃদ্ধি এবং পরমাণুর আকার ছােট হওয়ায় বাইরের শক্তিস্তরের ইলেকক্ট্রন নিউক্লিয়াসের সাথে অধিকতর দৃঢ়ভাবে আবদ্ধ থাকে ফলে বাইরের শক্তিস্তরের ইলেকট্রন প্রবেশ করিয়ে ঋণাত্মক আয়নে পরিণত করতে অধিক শক্তির নির্গত হয় । তাই, আমরা বলতে পারি, একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় ইলেকট্রন আসক্তির মান মান তত বাড়তে থাকে।
আবার, একই গ্রুপে যতই উপর থেকে নিচের দিকে যাওয়া যায় ততই বাইরের দিকে একটি করে নতুন শক্তিস্তর যুক্ত হয়। একটি করে নতুন শক্তিস্তর যুক্ত হলে পরমাণুর আকার বৃদ্ধি পায়। একই গ্রুপের উপর থেকে নিচের দিকে গেলে নিউক্লিয়াসের প্রােটন সংখ্যা এবং বাইরের কক্ষপথের ইলেকট্রন সংখ্যা বৃদ্ধির জন্য আকর্ষণ বৃদ্ধি হয়ে পরমাণুর আকার যতটুকু হ্রাস পায়, নতুন একটি শক্তিস্তর যােগ হওয়ার কারণে পরমাণুর আকার তার চেয়ে বেশি বৃদ্ধি পায়। ফলে বাহিরের শক্তিস্তরের ইলেক্ট্রন নিক্লিয়াস থেকে ক্রমশ দূরে সরে যায় এবং এর উপর নিউক্লিয়াসের আকর্ষণ কমতে থাকে । তাই, বাইরের শক্তিস্তরের ইলেক্ট্রন সহজে প্রবেশ করিয়ে ঋণাত্মক আয়নে পরিণত করতে তুলনামূলক কম শক্তির নির্গত হয় । সুতরাং আমরা বলতে পারি, যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় ইলেকট্রন আসক্তির মান তত কমতে থাকে ।
অর্থাৎ উপরিউক্ত আলোচনা থেকে বলা যায় যে,ইলেকট্রন আসক্তি একটি পর্যায়বৃত্ত ধর্ম।
একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় ইলেকট্রন আসক্তির মান তত বাড়তে থাকে এবং যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় ইলেকট্রন আসক্তির মান তত কমতে থাকে কেন তা ব্যাখ্যা করো ।
Cl এর ইলেকট্রন আসক্তির মান F এর ইলেকট্রন আসক্তির মান অপেক্ষা বেশি কেন ?(ব্যতিক্রম )
সাধারণত যে কোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় ইলেকট্রন আসক্তির মান তত কমতে থাকে তবে, 17 নং গ্রুপে হ্যালােজেন মৌলসমূহের মধ্যে ফ্লোরিন ও ক্লোরিন এর মধ্যে এর ব্যতিক্রম দেখা যায় । হ্যালােজেন মৌলসমূহের মধ্যে ফ্লোরিন মৌলের ইলেকট্রন আসক্তি সবচেয়ে বেশি হওয়া উচিত। কিন্তু তাদের ইলেকট্রন আসক্তির ক্রম হল Cl>F>Br>I অর্থাৎ ফ্লোরিনের ইলেকট্রন আসক্তি ক্লোরিন অপেক্ষা কম। এর কারণ ফ্লোরিন পরমাণুর ক্ষুদ্র আকার। ফ্লোরিন ও ক্লোরিন এর ইলেকট্রন বিন্যাস 9F= 1s2 2s2 2p5 17Cl= 1s2 2s2 2p6 3s23p5
ফ্লোরিনের ইলেকট্রন বিন্যাসের সর্বশেষ শক্তিস্তর হল দ্বিতীয় শক্তিস্তর। অপরদিকে ক্লোরিনের ইলেকট্রন বিন্যাসের সর্বশেষ শক্তিস্তর হল তৃতীয় শক্তিস্তর । তৃতীয় শক্তি স্তরের তুলনায় দ্বিতীয় শক্তি স্তরের আকার ছােট হওয়ায় এবং ক্ষুদ্র পরিসরে সাতটি ইলেকট্রন থাকায় তাতে ইলেকট্রন মেঘের ঘনত্ব তুলনামূলকভাবে অনেক বেশি। ফলে আগমনকারী ইলেকট্রনের প্রতি দ্বিতীয় শক্তি স্তরের ইলেকট্রনসমূহের পারস্পরিক বিকর্ষণ বেশি হওয়ায় সামগ্রিকভাবে ফ্লোরিনের ইলেকট্রন আসক্তির মান কম হয়।
অপরদিকে, ক্লোরিনের তৃতীয় শক্তিস্তর বড় হওয়ায় এতে যােজ্যতা স্তরের সাতটি ইলেকট্রন সহজে স্থান করে নেয়। ইলেকট্রন মেঘের ঘনত্ব হ্রাস পাওয়ায় ইলেকট্রন – ইলেকট্রন বিকর্ষণ কম হয়। এতে আগমনকারী ইলেকট্রন সহজে যােজ্যতা স্তরে প্রবেশ করতে পারে। ফলে ক্লোরিনের ইলেকট্রন আসক্তির মান ফ্লোরিনের চেয়ে বেশি হয়।
সমস্যা: Be, Ca, Sr, Ba, Mg এবং Ra মৌলগুলাের মধ্যে কোনােটির ইলেকট্রন আসক্তি বেশি এবং কোনােটির ইলেকট্রন আসক্তি কম।
সমাধান: Be, Ca, Sr, Ba, Mg এবং Ra মৌলগুলাে পর্যায় সারণির 2নং গ্রুপ-এর মৌল। এই মৌলগুলাের মধ্যে Be এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম, এর জন্য Be এর ইলেকট্রন আসক্তির মান সবচেয়ে বেশি। আবার Ra এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে বেশি, এর জন্য Ra ইলেকট্রন আসক্তি সবচেয়ে কম।
সমস্যা: Na, Mg, Al, Si এর মধ্যে কার ইলেকট্রন আসক্তি বেশি বা কার ইলেকট্রন আসক্তির মান কম?
সমাধান: Na, Mg, Al, Si এর মৌলগুলাে পর্যায় সারণির 3 নং পর্যায়ের মৌল। এই মৌলগুলাের মধ্যে Na এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে বেশি এজন্য সােডিয়াম এর ইলেকট্রন আসক্তির মান সবচেয়ে কম। আবার, Si এর পারমাণবিক ব্যাসার্ধের মান সবচেয়ে কম সেজন্য এর ইলেকট্রন আসক্তির মান সবচেয়ে বেশি।
***মৌলের ইলেকট্রন আসক্তি নিম্নোক্ত বিষয়ের উপর নির্ভরশীল:***
(iii) নিউক্লিয়াসে চার্জ বৃদ্ধিতে ইলেকট্রন আসক্তি বৃদ্ধি পায় -এটি হল পর্যায়ভিত্তিক সম্পর্ক।
(i) পরমাণুর আকার বৃদ্ধিতে ইলেকট্রন আসক্তি হ্রাস পায় –এটি হল গ্রুপভিত্তিক সম্পর্ক।
(ii) যােজ্যতা স্তরে ইলেকট্রনের ঘনত্ব বৃদ্ধিতে ইলেকট্রন আসক্তি হ্রাস পায় -এটি 17 নম্বর গ্রুপে দেখা যায়।
তড়িৎ ঋণাত্মকতা (Electronegativity)কাকে বলে?
দুটি পরমাণু যখন সমযােজী বন্ধনে আবদ্ধ হয়ে অণুতে পরিণত হয় তখন অণুর পরমাণুগুলাে বন্ধনের ইলেকট্রন দুটিকে নিজের দিকে আকর্ষণ করে। এই আকর্ষণকে তড়িৎ ঋণাত্মকতা বলা হয়।
সমযােজী H-Cl অণুতে একটি বন্ধন ইলেকট্রন-যুগল উভয় পরমাণু শেয়ার করে থাকে; যা উভয় পরমাণুর নিউক্লিয়াসকে কেন্দ্র করে আবর্তিত হয়। তবে H এর তুলনায় Cl-এর নিউক্ষিয়াস দ্বারা ঐ ইলেকট্রন মেঘ অধিক আকৃষ্ট হওয়ার কারণে ইলেকট্রন মেঘের ঘনত্ব Cl-পরমাণুর দিকে বেশি হয়ে থাকে।
ফলে HCl অণুটির H প্রান্তে আংশিক ধনাত্মক চার্জ (δ+) এবং Cl প্রান্তে আংশিক ঋণাত্মক চার্জ (δ-) ) সৃষ্টি হয়। তাই Cl পরমাণুকে অধিক তড়িৎ ঋণাত্মক পরমাণু বলে।
তড়িৎ ঋণাত্মকতা একটি পর্যায়বৃত্ত ধর্ম-ব্যাখ্যা করো।
আমরা জানি, পর্যায় সারণীর একই পর্যায় বা একই গ্রুপের মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে তাদের যে সব ধর্ম ক্রমান্বয়ে বা পর্যায়ক্রমে আবর্তিত বা পরিবর্তিত হয়, তাদেরকে পর্যায়বৃত্ত ধর্ম বলা হয় । তড়িৎ ঋণাত্মকতা একটি পর্যায়বৃত্ত ধর্ম। কারণ-একই পর্যায়ের বামের মৌলের পারমাণবিক ব্যাসার্ধ বেশি এবং ডানের মৌলের পারমাণবিক ব্যাসার্ধ কম। পারমাণবিক ব্যাসার্ধ কমলে তড়িৎ ঋণাত্মকতার মান বাড়ে এবং পারমাণবিক ব্যাসার্ধ বাড়লে তড়িৎ ঋণাত্মকতার মান কমে।
যেমন: 3 পর্যায়ে মৌলগুলাের মাঝে Na পরমাণুর তড়িৎ ঋণাত্মকতার মান সবচেয়ে কম এবং Cl এর তড়িৎ ঋণাত্মকতা সবচেয়ে বেশি। সাধারণত কোনাে মৌলের পরমাণুর আকার ছােট হলে তড়িৎ ঋণাত্মকতার মান বেশি হয় এবং কোনাে মৌলের পরমাণুর আকার বড় হলে তড়িৎ ঋণাত্মকতার মান কম হয়।
যে-কোন পর্যায়ে বামদিক থেকে যতই ডানদিকে যাওয়া যায়, মৌলের তড়িৎ ঋণাত্মকতা ততই বৃদ্ধি পায়। এর কারণ হচ্ছে একই পর্যায়ে মৌলসমূহের পারমাণবিক সংখ্যা বৃদ্ধির সাথে কোন নতুন ইলেকট্রন শক্তিস্তর বৃদ্ধি পায় না; কিন্তু নিউক্লিয়াসে ধনাত্মক চার্জের পরিমাণ বৃদ্ধি পাওয়ায় সর্বশেষ শক্তিস্তরের উপর নিউক্লিয়াসের আকর্ষণ বৃদ্ধি পায়; ফলে পরমাণুর আকার ক্রমশ হ্রাস পায়। এজন্য সমযােজী বন্ধনের শেয়ারকৃত ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ ক্রমশ বৃদ্ধি পায়। ফলে মৌলের তড়িৎ ঋণাত্মকতা ততই বৃদ্ধি পায়।
আবার, একই গ্রুপ বা শ্রেণীতে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে মৌলের তড়িৎ ঋণাত্মকতার মান হ্রাস পায়। এর কারণ হচ্ছে, একই শ্রেণীতে পারমাণবিক সংখ্যা বৃদ্ধির সাথে সাথে পরমাণুতে ইলেকট্রনের নতুন শক্তি স্তর যুক্তি হয় এবং পরমাণুর আকার বৃদ্ধি পায়। ফলে শেয়ারকৃত ইলেকট্রন নিউক্লিয়াস থেকে ক্রমশ দূরে অবস্থান করে এবং তাদের উপর নিউক্লিয়াসের আকর্ষণ হ্রাস পায়। ফলে পরমাণুর আকার ক্রমশ বৃদ্ধি পায়। এজন্য সমযােজী বন্ধনের শেয়ারকৃত ইলেকট্রনের উপর নিউক্লিয়াসের আকর্ষণ ক্রমশ কমে যায়। ফলে মৌলের তড়িৎ ঋণাত্মকতা ক্রমশ কমে যায়। অর্থাৎ উপরিউক্ত আলোচনা থেকে বলা যায় যে,তড়িৎ ঋণাত্মকতা একটি পর্যায়বৃত্ত ধর্ম।
একটি পর্যায়ের যতই বামদিক থেকে ডান দিকে যাওয়া যায় তড়িৎ ঋণাত্মকতার মান তত বাড়তে থাকে এবং যেকোনাে একটি গ্রুপের যতই উপর দিক থেকে নিচের দিকে যাওয়া যায় তড়িৎ ঋণাত্মকতার তত কমতে থাকে কেন তা ব্যাখ্যা করো ।
***মৌলের তড়িৎ ঋণাত্মকতা নিম্নোক্ত বিষয়ের উপর নির্ভশীল: ***
(i) নিউক্লিয়াসে চার্জ বৃদ্ধিতে তড়িৎঋণাত্মকতা বৃদ্ধি পায় – এটি হল পর্যায়ভিত্তিক সম্পর্ক।
(ii) পরমাণুর আকার বৃদ্ধিতে তড়িৎঋণাত্মকতা হ্রাস পায় – এটি হল গ্রুপভিত্তিক সম্পর্ক।
বিভিন্ন গ্রুপে উপস্থিত মৌলগুলাের বিশেষ নাম
(The Special Names of Elements Present in Various Groups)
মৌলসমূহের ভৌত ও রাসায়নিক ধর্মের উপর ভিত্তি করে বিভিন্ন সময়ে তাদের বিশেষ নাম দেওয়া হয়েছিল। আমরা ইতােমধ্যে ধাতু, অধাতু, অর্ধধাতু এবং অপধাতুর কথা আলােচনা করেছি। এছাড়া রয়েছে:)
ক্ষার ধাতু কাকে বলে?
যে সকল মৌল পানির সাথে বিক্রয়া করে ক্ষার ও হাইড্রোজেন গ্যাস তৈরি করে তাদেরকে ক্ষার ধাতু বলে। যেমন -পর্যায় সারণির 1 নং গ্রুপের ছয়টি মৌল যথাঃ লিথিয়াম(Li) , সোডিয়াম (Na) , পটাশিয়াম(K), রুবিডিয়াম(Rb), সিজিয়াম(Cs) এবং ফ্রানসিয়ামকে(Fr) ক্ষারধাতু বলা হয়।
লিথিয়াম(Li) / সোডিয়াম (Na) / পটাশিয়াম(K)/ রুবিডিয়াম(Rb)/ সিজিয়াম(Cs) এবং ফ্রানসিয়ামকে(Fr) ক্ষারধাতু বলা হয় কেন?
আমরা জানি, যে সকল মৌল পানির সাথে বিক্রয়া করে ক্ষার ও হাইড্রোজেন গ্যাস তৈরি করে তাদেরকে ক্ষার ধাতু বলে। লিথিয়াম (Li) পানির সাথে বিক্রয়া করে বা পানিতে দ্রবীভূত হয়ে ক্ষার ও হাইড্রোজেন গ্যাস তৈরি করে। এই জন্য লিথিয়ামকে (Li) ক্ষারধাতু বলা হয়।
2Na + 2H2O= 2NaOH + H2
(পর্যায় সারণির 1 নং গ্রুপে 7টি মৌল আছে। এদের মধ্যে হাইড্রোজেন ছাড়া বাকি দুটি মৌলকে (লিথিয়াম, সােডিয়াম, পটাশিয়াম, রুবিডিয়াম, সিজিয়াম এবং ফ্রানসিয়াম) ক্ষারধাতু বলে। এই ছয়টি মৌলের প্রত্যেকটি পানিতে দ্রবীভূত হয়ে হাইড্রোজেন গ্যাস এবং ক্ষার তৈরি করে বলে এদেরকে ক্ষারধাতু (Alkali Metals) বলা হয়।)
পর্যায় সারণির 1 নং গ্রুপ বা শ্রেণির( ক্ষার ধাতুসমূহের) বৈশিষ্ট
মৃৎক্ষার ধাতু কাকে বলে ?
যে সকল ধাতুকে মাটিতে বিভিন্ন যৌগ হিসেবে পাওয়া যায় এবং ক্ষার তৈরি করে তাদেরকে মৃৎক্ষার ধাতু বলে ।
যেমন :পর্যায় সারণির 2নং গ্রুপে বেরিলিয়াম, ম্যাগনেসিয়াম, ক্যালসিয়াম, স্ট্রনসিয়াম, বেরিয়াম এবং রেডিয়াম এই 6টি মৌল আছে। এই মৌলগুলােকে মৃৎক্ষার ধাতু বলে।
বেরিলিয়াম(Be), ম্যাগনেসিয়াম(Mg), ক্যালসিয়াম(Ca), স্ট্রনসিয়াম(Sr), বেরিয়াম(Ba) এবং রেডিয়ামকে(Ra) মৃৎক্ষার ধাতু বলা হয় কেন ?
বেরিলিয়াম, ম্যাগনেসিয়াম, ক্যালসিয়াম, স্ট্রনসিয়াম, বেরিয়াম এবং রেডিয়ামকে ধাতুগুলােকে মাটিতে বিভিন্ন যৌগ হিসেবে পাওয়া যায়। আবার, এরা ক্ষার তৈরি করে। এজন্য সামগ্রিকভাবে এদের মৃৎক্ষার ধাতু (Alkaline Earth Metals) বলা হয়।
পর্যায় সারণির 2 নং গ্রুপ বা শ্রেণির ( মৃৎক্ষার ধাতুসমূহের) বৈশিষ্ট
মুদ্রা ধাতু কাকে বলে ?
যে সকল ধাতু দিয়ে প্রাচীনকালে মুদ্রা তৈরি হতাে এবং ব্যবসাবাণিজ্য ও বিনিময়ের মাধ্যম হিসেবে ব্যবহার করা হতাে তাদেরকে মুদ্রা ধাতু বলে। যেমন :
কপার (Cu), সিলভার(Ag), গােল্ড(Ag).
কপার, সিলভার, গােল্ড ধাতুকে মুদ্রা ধাতু বলা হয় কেন ?
গ্রুপ-11 এর ৩ টি মৌল হচ্ছে কপার, সিলভার এবং গােল্ড । এই 3টি মৌলকে মুদ্রা ধাতু (Coin Metals) বলা হয়, কারণএই 3টি মৌল আছে তা দিয়ে প্রাচীনকালে মুদ্রা তৈরি হতাে এবং ব্যবসাবাণিজ্য ও বিনিময়ের মাধ্যম হিসেবে ব্যবহার করা হতাে।
হ্যালােজেন গ্রুপ/ হ্যালােজেন কাকে বলে ? এদেরকে হ্যালােজেন বলা হয় কেন ?
যে সকল মৌলের সাথে ধাতু যুক্ত হয়ে সামুদ্রিক লবণ উৎপন্ন করে তাদেরকে হ্যালোজেন বলে । অথবা গ্রুপ-17 এর 6টি মৌলকে হ্যালােজেন (Halogen) বলা হয়। যেমন: ফ্লোরিন (F), ক্লোরিন (Cl), ব্রোমিন (Br), আয়ােডিন (I), অ্যাস্টাটিন (As) এবং টেনেসিন (Ts)। হ্যালােজেনসমূহ কে X দ্বারা প্রকাশ করা হয়।
এই মৌলগুলোকে হ্যালােজেন বলা হয় কারণ এরা গ্রুপ-17 এর মৌল এবং এদের সাথে ধাতু যুক্ত হয়ে সামুদ্রিক লবণ উৎপন্ন করে ।
যেমন– F এর সাথে Na যুক্ত হয়ে সােডিয়াম ফ্লোরাইড (NaF) লবণ কিংবা Cl এর সাথে Na যুক্ত হয়ে সােডিয়াম ক্লোরাইড (NaCl) বা খাদ্য লবণ গঠিত হয়।
হ্যালােজেনসমূহ কীভাবে দ্বিমৌল অণু গঠন করে ?
হ্যালােজেনসমূহ নিজেরাই নিজেদের মধ্যে ইলেকট্রন ভাগাভাগি বা শেয়ারের মাধ্যমে দ্বিমৌল অণু তৈরি করে। যেমন: Cl2, I2 ইত্যাদি।
নিষ্ক্রিয় গ্যাস কাকে বলে ? এদেরকে নিষ্ক্রিয় গ্যাস বলা হয় কেন ?
যে সকল গ্যাসীয় মৌল অধিকতর স্থিতিশীলত ইলেকট্রন বিন্যাসের কারণে রাসায়নিক বিক্রিয়ায় তথা রাসায়নিক বন্ধন গঠনে অংশগ্রহণ করে না, তাদেরকে নিষ্ক্রিয় গ্যাস বলে। অথবা পর্যায় সারণির 18 নং গ্রুপের মৌলসমূহকে নিষ্ক্রিয় গ্যাস (Inert Gases) বলা হয়।
মৌলগুলাে হলাে: হিলিয়াম (He), নিয়ন (Ne), আর্গন (Ar), ক্রিপ্টন (Kr), জেনন (xe), রেডন (Rn)। এবং ওগানেসন (Og)।
এই মৌলগুলাের সবচেয়ে বাইরের শক্তিস্তরে প্রয়ােজনীয় ইলেকট্রন(হিলিয়ামের ক্ষেত্রে২টি (ns2) ও অন্যদের ক্ষেত্রে ৪টি (ns2np6) করে ইলেকট্রন ) দিয়ে পূর্ণ থাকে বলে এরা অন্য কোনো মৌল হতে ইলেক্ট্রন গ্রহণ করে না । অন্য কোনো মৌলকে ইলেক্ট্রন দান করে না । আবার ইলেকট্রন বিনিময় বা ভাগাভাগি করে কোনাে যৌগ গঠন করতে চায় না। এমনকি এরা নিজেদের মধ্যেও ইলেক্ট্রন শেয়ার বা ভাগাভাগি করে না। রাসায়নিক বন্ধন গঠন বা রাসায়নিক বিক্রিয়ায় এরা নিষ্ক্রিয় থাকে বলে এদেরকে নিষ্ক্রিয় মৌল বলে । আবার সাধারণ তাপমাত্রায় এরা গ্যাসগুলাে গ্যাস হিসেবে থাকে। ফলে সামগ্রিকভাবে এদেরকে নিষ্ক্রিয় গ্যাস বলা হয় ।
অবস্থান্তর মৌল কাকে বলে ? এদের বৈশিষ্টসমূহ লেখো ।
পর্যায় সারণির 3 নং গ্রুপ থেকে 12 নং গ্রুপের মৌলগুলােকে অবস্থান্তর মৌল বলে। অথবা যে সকল d-ব্লক মৌলের কোনো সুস্থিত বা স্থায়ী আয়নের d-অরবিটাল ইলেক্ট্রন দ্বারা আংশিক পূর্ণ ( d1-9 ) থাকে তাদেরকে অবস্থান্তর মৌল বলে।
এদের বৈশিষ্টসমূহ:
১)অবস্থান্তর মৌলগুলাে যে সকল যৌগ গঠন করে সে সকল যৌগ রঙিন হয়।
২) এরা সবগুলোই ধাতু ।
৩) এরা আয়নিক যৌগ গঠন করে ।
৪) এরা পরিবর্তনশীল যোজনী প্রদর্শন করে ।
৫) এরা বিভিন্ন বিক্রিয়ার প্রভাবক হিসেবে কাজ করে। যেমন: 10 নং গ্রুপের মৌল নিকেল একটি অবস্থান্তর মৌল নিকেল বিভিন্ন জৈব বিক্রিয়ার প্রভাবক হিসেবে কাজ করে।
Ca কে মৃৎক্ষার ধাতু বলা হয় কেন?
আমরা জানি,যে সকল ধাতুকে মাটিতে বিভিন্ন যৌগ হিসেবে পাওয়া যায় এবং ক্ষার তৈরি করে তাদেরকে মৃৎক্ষার ধাতু বলে ।
Ca ধাতুর বিভিন্ন যৌগ মাটিতে পাওয়া যায়। অতএব ক্যালসিয়াম মৃৎক্ষার ধাতু। আবার Ca ধাতুর হাইড্রোক্সাইড যৌগ Ca(OH)2 একটি ক্ষার। অতএব Ca একটি ক্ষারধাতু। সামগ্রিকভাবে Ca কে মৃৎক্ষার ধাতু বলা হয়।
He কেন নিষ্ক্রিয় গ্যাস? ব্যাখ্যা করাে।
যে সকল গ্যাসীয় মৌল অধিকতর স্থিতিশীলত ইলেকট্রন বিন্যাসের কারণে রাসায়নিক বিক্রিয়ায় তথা রাসায়নিক বন্ধন গঠনে অংশগ্রহণ করে না, তাদেরকে নিষ্ক্রিয় গ্যাস বলে।
He নিজেদের সাথে যুক্ত হয় না আবার অন্য মৌলের সাথে যুক্ত হয় না। এজন্য হিলিয়াম নিষ্ক্রিয় মৌল। আবার সাধারণ তাপমাত্রায় হিলিয়াম মৌল গ্যাস হিসেবে অবস্থান করে। এজন্যই সামগ্রিকভাবে He কে নিষ্ক্রিয় গ্যাস বলা হয়।
পর্যায় সারণির সুবিধাসমূহ (Advantages of the Periodic Table) আলোচনা করো।
পর্যায় সারণি বিভিন্ন রসায়নবিদের নিরলস প্রচেষ্টায় গড়া রসায়নের জগতে এক অসামান্য অবদান। রসায়ন অধ্যয়ন, নতুন মৌল সম্পর্কে ভবিষ্যদ্বাণী, গবেষণা ইত্যাদিতে পর্যায় সারণি বিরাট ভূমিকা পালন করে। নিচে তার কয়েকটি উদাহরণ তুলে ধরা হলাে:
(a) রসায়ন পাঠ সহজীকরণ: 2016 সাল পর্যন্ত পৃথিবীতে 118টি মৌল আবিষ্কার করা হয়েছে। আমরা যদি শুধু 4টি ভৌত ধর্ম, যেমন গলনাঙ্ক, স্ফুটনাঙ্ক, ঘনত্ব ও কঠিন/তরল/গ্যাসীয় অবস্থা এবং এটি রাসায়নিক ধর্ম, যেমন- অক্সিজেন, পানি, এসিড ও ক্ষারের সাথে বিক্রিয়া বিবেচনা করি তাহলে 118টি মৌলের মােট 118 x (4 + 4) = 944টি ধর্ম বা বৈশিষ্ট্য লক্ষ করা যায়। এতগুলাে ধর্ম মনে রাখা অসম্ভব ব্যাপার। কিন্তু পর্যায় সারণি সে কাজটিকে অনেক সহজ করে দিয়েছে। এ পর্যায় সারণিতে রয়েছে আঠারােটি গ্রুপ আর সাতটি পর্যায়। প্রতিটি গ্রুপের সাধারণ ধর্ম জানলে 118টি মৌলের ভৌত ও রাসায়নিক ধর্ম সম্বন্ধে একটি মােটামুটি ধারণা লাভ করা যায়। শুধু তাই নয়, পর্যায় সারণি সম্পর্কে ভালােভাবে ধারণা থাকলে বিভিন্ন মৌল দ্বারা গঠিত তাদের যৌগের ধর্ম সম্পর্কেও ধারণা লাভ করা যেতে পারে।
(b) নতুন মৌলের আবিষ্কার: কিছু দিন আগেও সাতটি পর্যায় আর আঠারােটি গ্রুপ নিয়ে গঠিত পর্যায় সারণিতে বেশ কিছু ফাঁকা ঘর ছিল। এই মৌলগুলাে আবিষ্কার হবার আগেই ঐ ফাঁকা ঘরে যে মৌলগুলাে বসবে বা তাদের ধর্ম কেমন হবে তা পর্যায় সারণি থেকে ধারণা পাওয়া গিয়েছিল। তােমরা ইতােমধ্যে জেনে গেছ যে বিজ্ঞানী মেন্ডেলিফ তাঁর সময়ে আবিষ্কৃত 63টি মৌলকে তার আবিষ্কৃত পর্যায় সারণিতে স্থান দিতে গিয়ে যে মৌলগুলাে সম্পর্কে ভবিষ্যদ্বাণী করেছিলেন সেগুলাে পরে আবিষ্কৃত হয়েছিল।
(c) গবেষণা ক্ষেত্রে: গবেষণার ক্ষেত্রেও পর্যায় সারণির অসামান্য অবদান রয়েছে। মনে করাে, কোনাে একজন বিজ্ঞানী কোনাে একটি বিশেষ প্রয়ােজনের জন্য নতুন একটি পদার্থ আবিষ্কার করতে চাইছেন। তাহলে আগেই তাঁকে ধারণা করতে হবে যে, নতুন পদার্থটির ধর্ম কেমন হবে এবং সেই সকল ধর্মবিশিষ্ট পদার্থ তৈরি করতে কী ধরনের মৌল প্রয়ােজন হবে। তার এ ধারণা পর্যায় সারণি থেকেই পাওয়া যাবে।
এছাড়া পর্যায় সারণির আরও অনেক ধরনের ব্যবহার আছে যা তােমরা ধীরে ধীরে জানতে পারবে।
পর্যায় সারণির একই গ্রুপের মৌলগুলাে দ্বারা গঠিত যৌগের বিক্রিয়াসমূহ আলোচনা করো।
(Reactions Occurring in the Elements of the Same Group)
পর্যায় সারণির একই গ্রুপের মৌলগুলাে যে একই রকম ধর্ম প্রদর্শন করে তা একটি পরীক্ষার মাধ্যমে ব্যাখ্যা করো
হ্যালোজেন মৌলগুলো যে একই রকম ধর্ম ও বিক্রিয়া প্রদর্শন করে তা ব্যাখ্যা করো ।
17 নং গ্রুপের মৌল F2, Cl2, Br2, I2 ইত্যাদি গ্যাস হাইড্রোজেনের সাথে বিক্রিয়া করে যথাক্রমে HF (g), HCl (g), HBr (g) , HI (g) ইত্যাদি গ্যাস উৎপন্ন করে।
H2(g) + F2(g) → 2HF (g)
H2(g) + Cl2(g) → 2HCl (g)
H2(g) + Br2(g) → 2HBr (g)
H2(g) + l2(g) → 2HI (g)
আবার, এই গ্যাসগুলােকে যদি পানিতে দ্রবীভূত করা হয় তাহলে হাইড্রোহ্যালাইড এসিড যথা হাইড্রোক্লোরিক এসিড [HF(aq)], হাইড্রোক্লোরিক এসিড [HCl(aq)], হাইড্রোব্রোমিক এসিড [HBr(aq)], হাইড্রোআয়ােডিক এসিডে [HI(aq)] পরিণত হয়।
HF(g) + H2O (l) → HF (aq)
HCl(g) + H2O (l) → HCl (aq)
HBr(g) + H2O (l) → HBr (aq)
HI(g) + H2O (l) → HI (aq)
এই হাইড্রোহ্যালাইড এসিডসমূহ যেকোনাে কার্বনেট লবণের সাথে বিক্রিয়া করে কার্বন ডাইঅক্সাইড গ্যাস উৎপন্ন করে। যেমন- ক্যালসিয়াম কার্বনেটের মধ্যে হাইড্রোক্লোরিক এসিড যােগ করলেও কার্বন ডাই-অক্সাইড গ্যাস উৎপন্ন হয়।
CaCO3 + 2HF (aq) → CaF2 + CO2 + H2O
আবার, ক্যালসিয়াম কার্বনেটের মধ্যে হাইড্রোক্লোরিক এসিড যোগ করলেও কার্বন ডাই-অক্সাইড গ্যাস তৈরি হয়।
CaCO3 + 2HCl (aq) → CaCl2 + CO2 + H2O
উপরের বিক্রিয়াগুলাে থেকে বােঝা যায় যে, 17 নং গ্রুপের মৌল, F2, Cl2, Br2, I2 একই রকমের ধর্ম ও বিক্রিয়া প্রদর্শন করে।
2 নং গ্রুপের মৌল (Be, Mg, Ca, Sr ইত্যাদি )একই রকমের ধর্ম ও বিক্রিয়া প্রদর্শন করে-ব্যাখ্যা করো ।
আমরা জানি, পর্যায় সারণির একই গ্রুপে অবস্থিত মৌলসমূহ একই রকমের ধর্ম ও বিক্রিয়া প্রদর্শন করে । 2 নং গ্রুপের মৌলসমূহ হলো Be, Mg, Ca, Sr, Ba, Ra . যেহেতু এরা একই গ্রুপে মৌল ,সেহেতু এরা একই রকমের ধর্ম ও বিক্রিয়া প্রদর্শন করে। যেমন –
2 নং গ্রুপের মৌলসমূহ লঘু হাইড্রোক্লোরিক এসিডের সাথে বিক্রিয়া করে ধাতব লবন ও হাইড্রোজেন গ্যাস উৎপন্ন করে ।
Be + 2 HCl = BeCl2 + H2
Mg + 2 HCl = MgCl2 + H2
Ca + 2HCl = CaCl2 + H2
Sr + 2HCl = SrCl2 + H2
2 নং গ্রুপের মৌলসমূহর কার্বনেট লবণকে উত্তপ্ত করলে এরা বিযোজিত হয়ে ধাতব অক্সাইড ও কার্বন ডাই অক্সাইড গ্যাস উৎপন্ন করে ।
BeCO3 = BeO + CO2
MgCO3 = MgO + CO2
CaCO3 = CaO + CO2
SrCO3 = SrO + CO2
2 নং গ্রুপের মৌলসমূহর কার্বনেট লবণ লঘু হাইড্রোক্লোরিক এসিডের সাথে বিক্রিয়া করে ক্লোরাইড লবন ,কার্বন ডাই অক্সাইড গ্যাস ও পানি উৎপন্ন করে ।
BeCO3 + 2HCl = BeCl2 + CO2 + H2O
MgCO3 + 2HCl = MgCl2 + CO2 + H2O
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
SrCO3 + 2HCl = SrCl2 + CO2 + H2O
সুতরাং উপরের আলোচনা থেকে এটা স্পষ্ট যে, 2 নং গ্রুপের মৌলসমূহ একই রকমের ধর্ম ও বিক্রিয়া প্রদর্শন করে ।
ক্যালসিয়াম কার্বনেটের সাথে লঘু হাইড্রোক্লোরিক এসিডের বিক্রিয়ায় উৎপন্ন গ্যাস যে কার্বন ডাই-অক্সাইড তা কীভাবে প্রমাণ করবে ?
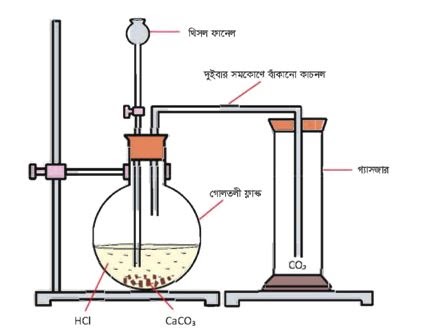
পরীক্ষণের নাম: ক্যালসিয়াম কার্বনেটের সাথে লঘু হাইড্রোক্লোরিক এসিডের বিক্রিয়ায় উৎপন্ন কার্বন ডাই-অক্সাইড গ্যাস শনাক্তকরণ।
মূলনীতি: ক্যালসিয়াম কার্বনেট লঘু হাইড্রোক্লোরিক এসিডের সাথে বিক্রিয়া করে ক্যালসিয়াম ক্লোরাইড, পানি এবং কার্বন ডাইঅক্সাইড গ্যাস উৎপন্ন করে।
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
প্রয়ােজনীয় উপকরণ
যন্ত্রপাতি: 1. একটি গােলতলী ফ্লাক 2. একটি থিসল ফানেল 3. দুইবার সমকোণে বাঁকানাে একটি কাচের নির্গম নল 4. কয়েকটি গ্যাসজার 5. ছিদ্রযুক্ত ছিপি।
রাসায়নিক দ্রব্যাদি: 1. ক্যালসিয়াম কার্বনেট 2. লঘু হাইড্রোক্লোরিক এসিড 3. পানি।
কার্যপদ্ধতি:
- একটি গােলতলী ফ্লাস্কে ক্যালসিয়াম কার্বনেটের কিছু ছােট টুকরাে নিই
- ছিপির সাহায্যে উলফ বােতলের এক মুখ দিয়ে একটি থিসল ফানেল এবং অপর মুখ দিয়ে দুইবার সমকোণে বাঁকানাে নির্গম নলের এক প্রান্ত প্রবেশ করাই ।

চিত্র : কার্বন ডাই-অক্সাইড প্রস্তুত।
- থিসল ফানেলের মধ্য দিয়ে কিছু পরিমাণ পানি গােলতলী ফ্লাকে নেওয়া হলাে যেন ক্যালসিয়াম কার্বনেট এবং থিসল ফানেলের নিম্নপ্রান্ত পানিতে ডুবে থাকে।
- নির্গম নলের অন্য প্রান্ত একটি গ্যাসজারে প্রবেশ করাই ।
- এরপর থিসল ফানেলের ভিতর দিয়ে ধীরে ধীরে হাইড্রোক্লোরিক এসিড যােগ করি। দেখা গেল ক্যালসিয়াম কার্বনেট এবং হাইড্রোক্লোরিক এসিড বিক্রিয়া করে যে কার্বন ডাইঅক্সাইড গ্যাস তৈরি করছে তা বুদ বুদ্ আকারে নির্গম নল দিয়ে বের হয়ে আসছে।
- নির্গম নল দিয়ে বের হয়ে আসা গ্যাসকে গ্যাসজারে সংরক্ষণ করি। যেহেতু কার্বন ডাই-অক্সাইড বাতাসের অন্যান্য গ্যাস অপেক্ষা তুলনামূলক ভারী, সেহেতু কার্বন ডাই-অক্সাইড সিলিন্ডারের নিচের দিকে জমা হবে।
কার্বন ডাই-অক্সাইড গ্যাসের ধর্ম পরীক্ষা: 1. উৎপন্ন কার্বন ডাই-অক্সাইড গ্যাসের বর্ণ লক্ষ করা হলাে। কার্বন ডাই-অক্সাইডের কোনাে বর্ণ দেখা গেল না।
- গ্যাসজারের মুখে একটি জ্বলন্ত কাঠি ধরি । কাঠিটির আগুন নিভে গেল। সিদ্ধান্ত নেওয়া হলাে কার্বন ডাই-অক্সাইড গ্যাস আগুন নিভাতে সাহায্য করে।
- একটি টেস্টটিউব বা পরীক্ষানলে চুনের পানি বা ক্যালসিয়াম হাইড্রোক্সাইড নিয়ে তার মধ্যে উৎপন্ন কার্বন ডাই-অক্সাইড গ্যাস প্রবেশ করাই । প্রথমে সামান্য গ্যাস প্রবেশ করে ক্যালসিয়াম হাইড্রোক্সাইডের সাথে বিক্রিয়া করে ক্যালসিয়াম কার্বনেটের সাদা বর্ণের অধঃক্ষেপ তৈরি হলাে। Ca(OH)2 + CO2 → CaCO3 + H2O
ফলে চুনের পানি ঘােলা হলাে। এখানে অদ্রবণীয় CaCO3 উৎপন্ন হওয়ার জন্য চুনের পানিকে ঘােলা দেখায়।
এরপর আরও অধিক গ্যাস এই ঘােলা পানির মধ্যে প্রবেশ করানাে হলাে ফলে ক্যালসিয়াম কার্বনেট, পানি এবং কার্বন ডাই-অক্সাইড বিক্রিয়া করে ক্যালসিয়াম বাইকার্বনেট তৈরি করল। CaCO3 + CO2 + H2O → Ca(HCO3)2 এতে চুনের ঘােলা পানি আবার পরিষ্কার হয়ে গেল।এখানে দ্রবণীয় Ca(HCO3)2 উৎপন্ন হওয়ার জন্য চুনের ঘােলা পানি আবার পরিষ্কার হয়ে গেল।
সতর্কতা: 1. থিসল ফানেলের শেষ প্রান্ত পানির নিচে যাতে সব সময় ডুবে থাকে সেই ব্যবস্থা নেওয়া হয়েছিল।
- গােলতলী ফ্লাস্ককে একটি স্ট্যান্ডের সাথে আটকিয়ে রাখা হয়েছিল।
এই পরীক্ষণের জন্য ক্যালসিয়াম কার্বনেটের পরিবর্তে শামুক, ঝিনুক, ডিমের খােসা এবং হাইড্রোক্লোরিক এসিডের পরিবর্তে ভিনেগার ব্যবহার করা যায়।